Triazine
| Triazine | |||||||
| Name | 1,2,3-Triazin | 1,2,4-Triazin | 1,3,5-Triazin | ||||
| Andere Namen | v-Triazin vic-Triazin |
as-Triazin asym-Triazin |
s-Triazin sym-Triazin | ||||
| Strukturformel | 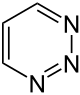 |
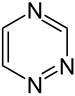 |
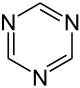
| ||||
| CAS-Nummer | 289-96-3 | 290-38-0 | 290-87-9 | ||||
| EG-Nummer | 808-989-8 | 206-028-1 | |||||
| ECHA-Infocard | 100.236.897 | 100.005.481 | |||||
| PubChem | 123047 | 67520 | 9262 | ||||
| Summenformel | C3H3N3 | ||||||
| Molare Masse | 81,08 g/mol | ||||||
| Aggregatzustand | fest | flüssig | fest | ||||
| Kurzbeschreibung | blassgelbes Öl | farblose, stark lichtbrechende, rhomboedrische Kristalle | |||||
| Schmelzpunkt | 70 °C | 17 °C | 86 °C | ||||
| Siedepunkt | 156 °C | 114 °C | |||||
| Dichte | 1,448 g/cm3 | 1,38 g/cm3 | |||||
| Löslichkeit | löslich in Ethanol,
Diethylether; Zersetzung in Wasser | ||||||
| GHS- Kennzeichnung |
Achtung |
|
Gefahr | ||||
| H- und P-Sätze |
|
siehe oben |
| ||||
| Fehlende P-Sätze | siehe oben |
| |||||
Als Triazine wird eine Gruppe chemischer Verbindungen bezeichnet, deren Grundstruktur ein aromatischer Heterocyclus ist, der drei Stickstoffatome im sechsgliedrigen Ringsystem enthält.
Die unsubstituierten Stammverbindungen haben nur eine geringe Bedeutung. Von den substituierten Derivaten kommt den symmetrischen 1,3,5-Triazinen, bei denen der Sechsring aus jeweils drei abwechselnd angeordneten Kohlenstoff- und Stickstoffatomen besteht, vor allem als vielseitige Bausteine für weitere Synthesen Bedeutung zu.
Geschichte
Das erste kommerziell genutzte Triazin war das Fungizid Anilazin (1953). Darauf folgten die Triazin-Herbizide aus der Gruppe der Chlordiaminotriazine, die 1954 von J. R. Geigy (heute: Novartis) zum Patent angemeldet wurden.
Später kamen die Methylmercaptodiaminotriazine (Triatryne) und die Methoxydiaminotriazine (Triatone) dazu.
Eigenschaften
Das cyclische Trimere der Blausäure 1,3,5-Triazin zersetzt sich erst oberhalb von 600 °C in Blausäure, Stickstoff und Kohlendioxid.
Verwendung
Mehrere Triazine, wie Atrazin und Simazin, waren als wirksame Herbizide vor allem im Maisanbau weit verbreitet, sind aber heute aufgrund ihrer grundwassergefährdenden Persistenz in der EU verboten. Das Umweltverhalten (Bioakkumulation, Adsorption, Toxizität) ist je nach chemischer Struktur und Seitenkette stark unterschiedlich.
Auch zahlreiche andere bedeutsame chemische Zwischenprodukte enthalten die Triazinstruktur. So enthalten zum Beispiel viele Reaktivfarbstoffe chlor- oder fluorsubstituierte Triazine als „reaktive Anker“: Der Chromophor wird an den Triazinring gebunden, der dann beim Färbeprozess unter alkalischen Bedingungen mit einer OH-Gruppe der Cellulose (Baumwolle) unter HCl-Abspaltung reagiert. Dabei wird der Farbstoff über eine kovalente chemische Bindung an die Baumwollfaser gebunden, woraus eine hohe Waschechtheit resultiert.
Derivate (Auswahl)
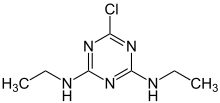
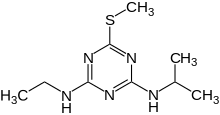
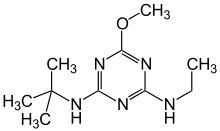
- Acetoguanamin
- Atrazin
- Cyanazin
- Cyanurchlorid
- Cyanurfluorid
- Cyanursäure
- Cyanurtriazid
- Cybutryn
- Desmetryn
- Prometon
- Prometryn
- Propazin
- Melamin


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 15.07. 2023

