Myoglobin
| Myoglobin | ||
|---|---|---|
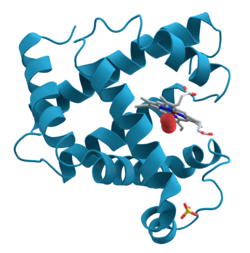
| ||
| Bändermodell von Myoglobin (α-Helices) mit Häm (Stäbchenmodell) | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 153 Aminosäuren, 17053 Dalton | |
| Sekundär- bis Quartärstruktur | Monomer | |
| Bezeichner | ||
| Gen-Namen |
| |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie |
| |
| Übergeordnetes Taxon | Chordatiere | |
Myoglobin ist ein Muskelprotein (von griech. μῦς, mŷs ‚Muskel‘ und lat. globus ‚Kugel‘) aus der Gruppe der Globine, kugelförmigen Proteinen, die eine sauerstoffbindende Hämgruppe enthalten. Myoglobin kann Sauerstoff aufnehmen und wieder abgeben und ist verantwortlich für den intramuskulären Sauerstofftransport. Es übernimmt den Sauerstoff aus dem Blut vom Hämoglobin und gibt ihn am Ort der physiologischen Verbrennungsprozesse in den Muskelzellen wieder ab.
Wissenschaftliche Beschreibung
Myoglobin ist ein Häm-basiertes, globuläres, einkettiges Protein aus 153 Aminosäuren mit einer Molekülmasse von 17.053 Dalton (17 kDa), das die Fähigkeit besitzt, Sauerstoff (O2) reversibel zu binden. Die Sekundärstruktur des Proteins besteht aus insgesamt acht α-Helices.
Unter physiologischen Bedingungen liegt es als Monomer vor. Das aktive Zentrum des Myoglobins ist ein Häm b, d.h. ein Protoporphyrin IX mit einem über die vier inneren Stickstoffe ligierten Eisen(II)-Ion. Das Häm ist über ein axial an das zentrale Eisenion koordiniertes, proximales Histidin an die Proteinmatrix gebunden. Die zweite axiale Position dient der Bindung des Sauerstoffmoleküls.
Im Gegensatz zum strukturverwandten Hämoglobin bindet Myoglobin den Sauerstoff nicht positiv kooperativ. Das Bindungsverhalten von O2 an Myoglobin lässt sich durch das Auftragen des Sättigungsgrades Y gegen den Sauerstoffpartialdruck pO2 in einem Koordinatensystem beschreiben. Y=0 bedeutet hierbei, dass kein Sauerstoff gebunden ist, wohingegen das Myoglobin bei Y=1 vollständig mit O2 gesättigt ist. Der O2-Partialdruck bei halbmaximaler Sättigung (Y=0,5) wird als p50 bezeichnet. Die experimentelle Untersuchung des Bindungsverhaltens von Myoglobin ergibt dann eine hyperbolische Kurve, die sich wie folgt interpretieren lässt: Bei niedrigem pO2 wird Sauerstoff von Myoglobin praktisch vollständig aufgenommen. Diese Phase entspricht einem steilen und näherungsweise linearen Anstieg der Kurve. Bei höheren pO2 wird es für die Sauerstoffmoleküle zunehmend unwahrscheinlicher, ungesättigtes Myoglobin anzutreffen. Die Bindung nähert sich daher dem Zustand vollständiger Sättigung, repräsentiert durch den immer schwächer ansteigenden asymptotischen Teil der Kurve.
Das Vorkommen von Myoglobin ist auf Herz- und Skelettmuskelzellen von Wirbeltieren beschränkt. Hier liegt es in hohen Konzentrationen (bis etwa 100 µmol/l) vor und gibt dem Muskelgewebe seine rote Farbe. Die Sauerstoffaufnahme kann gut absorptionsspektroskopisch verfolgt werden, die charakteristische Soret-Bande des Häm verschiebt sich bei Sauerstoffaufnahme deutlich von 418 zu 434 nm.
Myoglobin zählt zu den Globinen. Dem Myoglobin nah verwandt ist das erst 2002 beschriebene Cytoglobin, welches in nahezu allen Zellen der Wirbeltiere vorkommt. Es dient vermutlich ebenso als Sauerstoffspeicher in der Zelle. Es scheint sogar, dass Myoglobin wohl während der Evolution durch eine Genduplikation die muskelspezifische Variante des Cytoglobins geworden ist.
Bedeutung
Als biologische Funktion des Myoglobins wird der Sauerstoff-Transport innerhalb der Muskelzelle, von der Zellmembran zu den Mitochondrien, angesehen. Aus diesem Grund ist seine Affinität zum Sauerstoff auch höher als bei Hämoglobin, dies fördert den Sauerstofftransport in Richtung Zellinneres. Auch die beim Hämoglobin beobachtete Regulation der Sauerstoffaffinität fehlt dem Myoglobin. Zumindest bei Meeressäugetieren wird auch die Sauerstoff-Speicherung diskutiert: Wale haben einen etwa 5- bis 10-mal höheren Myoglobin-Gehalt in ihrer Muskulatur als Landsäugetiere. Beim Menschen enthalten die Muskeln etwa 6 Gramm Myoglobin pro Kilogramm, beim Seehund sind es 52, beim Pottwal sogar 56 Gramm. Dort dient es den Meeressäugern beim Tauchen als Sauerstoffvorrat.
Das Myoglobin des Pottwals war daher auch das erste Protein, an dem John Kendrew 1958 eine Strukturaufklärung (Röntgenstrukturanalyse) gelang. Diese Pionierleistung war Grundlage für die spätere Aufklärung der Hämoglobin-Struktur durch Max Perutz (1959). Beide Wissenschaftler erhielten 1962 den Nobelpreis für Chemie.
Ein Maß für den Myoglobingehalt ist der Eisengehalt. Dieser ist bei Schweinefleisch binnen 30 Jahren um ca. 75 % auf durchschnittlich 4,1 mg/kg Frischmasse gefallen.
Bedeutung in der Medizin
Ein Anstieg der Myoglobinkonzentration im Blutserum von Säugetieren deutet auf Rhabdomyolyse hin und kann als Indikator für einen Herzinfarkt gelten. Da ein erhöhter Myoglobinwert aber unspezifisch ist, verwendet man heute kardiale Troponine zur Herzdiagnostik. Außer beim Untergang von Herzmuskelzellen zeigen sich erhöhte Myoglobinwerte auch bei Schädigung der Skelettmuskulatur (extremer Sport, epileptische Anfälle, Polytrauma, intramuskuläre Injektionen, Alkoholintoxikation, Muskelerkrankungen, Verschüttungen). Wird bei einem Stromschlag Muskelgewebe verletzt, hat dies eine Freisetzung von Myoglobin zur Folge. Stark erhöhte Myoglobin-Konzentrationen können dabei zu einem akuten Nierenversagen führen (Crush-Niere).>
Die Plasmahalbwertszeit von Myoglobin beträgt nur 10 bis 20 min, da es rasch über die Nieren ausgeschieden wird (glomeruläre Filtration). Der Myoglobinwert steigt bei einem Herzinfarkt nach ca. 1–2 Stunden an und erreicht sein Maximum nach 4–6 Stunden. Bereits innerhalb von 12–24 Stunden sinkt es wieder in den Normbereich ab.
Normwerte beim Menschen im Blut: Frauen bis 35 µg/l, Männer bis 55 µg/l
Normwert beim Menschen im Urin: Frauen und Männer bis 0,3 mg/l
Literatur
- Brunori M: Myoglobin strikes back. In: Protein Sci. 19. Jahrgang,
Nr. 2, Februar 2010,
S. 195–201, doi:
 10.1002/pro.300,
10.1002/pro.300,
 PMID 19953516.
PMID 19953516. - Springer-Verlag GmbH: Biochemie : Eine Einführung für Mediziner und Naturwissenschaftler. 3., korrigierte Auflage. Berlin, ISBN 978-3-662-54850-9.>


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 02.06. 2025