Aminosäuren
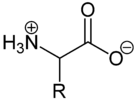
Aminosäuren (unüblich Aminocarbonsäuren, veraltet Amidosäuren) sind eine Klasse organischer Verbindungen mit mindestens einer Carboxygruppe (–COOH) und einer Aminogruppe (–NH2), gehören also sowohl zur Gruppe der Carbonsäuren, als auch zu jener der Amine. Die Stellung der Aminogruppe zur Carboxygruppe teilt die Klasse der Aminosäuren in Gruppen auf. Die wichtigsten Aminosäuren haben eine endständige Carboxygruppe und in direkter Nachbarschaft die Aminogruppe. Dies nennt man vicinal oder α-ständig; diese Aminosäuren gehören zu den so genannten α-Aminosäuren.
Der Begriff Aminosäuren wird häufig vereinfachend als Synonym für die proteinogenen Aminosäuren verwendet. Diese α-Aminosäuren sind die Bausteine der Proteine. Bisher sind 23 proteinogene Aminosäuren bekannt, das Spektrum der Klasse der Aminosäuren geht aber weit über diese hinaus. So sind bisher 400 nichtproteinogene natürlich vorkommende Aminosäuren bekannt, die biologische Funktionen haben. Die Anzahl der synthetisch erzeugten und die der theoretisch möglichen Aminosäuren ist noch erheblich größer. Eine spezielle Gruppe stellen die vergleichsweise seltenen D-Aminosäuren dar.
Aminosäuren konnten bisher nicht nur auf der Erde, sondern bereits auch auf Kometen, Meteoriten und sogar in Gaswolken im interstellaren Raum nachgewiesen werden.
Gewinnung und Produktion
Aminosäuren werden entweder aus Naturstoffen durch Auftrennung eines hydrolysierten Proteins oder auf synthetischem Wege gewonnen. Als erste Aminosäure wurde 1805 Asparagin isoliert (Louis-Nicolas Vauquelin). Ursprünglich diente die Entwicklung einer Synthese für die diversen Aminosäuren hauptsächlich der Strukturaufklärung. Inzwischen sind diese Strukturfragen gelöst und mit den verschiedenen Synthesen, soweit sie noch aktuell sind, werden gezielt die gewünschten Aminosäuren dargestellt. Bei den Synthesen entstehen zunächst racemische Gemische, die getrennt werden können. Eine Methode hierfür ist beispielsweise eine selektive enzymatische Hydrolyse. Näheres hierzu unter Trennverfahren.
Nachfolgend ein Überblick über diverse Synthesen, die von Chemikern bereits ab Mitte des 19. Jahrhunderts entwickelt wurden. Einige dieser älteren Synthesen sind wegen geringer Ausbeuten oder sonstiger Probleme nur von historischem Interesse. Allerdings wurden diese alten Verfahren teilweise weiterentwickelt und einige sind auch noch heute zur Darstellung von Aminosäuren aktuell. Weitergehende Einzelheiten zu diesen Synthesen einschließlich der Gleichungen für die Synthesen sind unter den Links zu den Synthesen und den angegebene Aminosäuren angeführt.
- Mit der Cyanhydrinsynthese nach Adolf Strecker wurde 1850 das Alanin erstmals aus Acetaldehyd synthetisiert.
- Eine Synthese für die Darstellung von Glycin über die α-Fettsäuren, die durch Reaktion von Brom- oder Chlorfettsäuren mit Ammoniak hergestellt werden, ist von W. H. Perkin sen. und Duppa bereits 1858 entwickelt worden.
- J. Pöchl entdeckte 1883 die Azlactonsynthese zur Darstellung von Aminosäuren. Deren genauer Ablauf wurde aber erst 1893 von Emil Erlenmeyer jun. aufgeklärt. Diese Methode wird deshalb auch Erlenmeyer-Synthese genannt. Mit diesem Verfahren wurden 1911 Histidin sowie Phenylalanin und Thyroxin hergestellt.
- Durch Reduktion von einer α-Oximinosäure wurde erstmals 1887 Asparaginsäure synthetisiert. Nach der gleichen Methode wurde 1906 von L. Bouveault Isoleucin aus dem Oxim des Methyläthyl-brenztraubensäureesters dargestellt.
- Nach der von Siegmund Gabriel entwickelten Gabriel-Synthese, wurde 1889 Glycinhydrochlorid über Phthalimidkalium als Ausgangschemikalie synthetisiert. Obwohl diese Synthese für die Darstellung von Glycin überholt ist, eignet sie sich wegen ihrer hohen Ausbeuten für die Gewinnung anderer Aminosäuren.
- Mit der Cyanhydrinsynthese stellte Emil Fischer 1902 erstmals Serin über Glykolaldehyd her. 1906 wurde mit der von ihm entwickelten Malonestersynthese Leucin synthetisiert. Norleucin, Methionin und Phenylalanin sind weitere Aminosäuren, die mit dieser Synthese leicht darstellbar sind.
- Theodor Curtius benutzte den von ihm entwickelten Curtiusschen Abbau für die Darstellung von α-Aminosäuren durch die Verwendung von Malonesterderivaten zur Synthese von Glycin, Alanin, Valin und Phenylalanin.
- 1911 wurde Tyrosin, Phenylalanin und Tryptophan über eine Kondensation aromatischer Aldehyde mit Hydantoin gewonnen.
- Mit einer kombinierten Phthalimid-Malonester-Synthese wurde 1931 von G. Barger Methionin synthetisiert. Nach der gleichen Methode können auch Phenylalanin, Prolin, Tyrosin, Asparaginsäure und Serin hergestellt werden. V. du Vigneaud stellte 1939 DL-Cystin mit dieser Methode her.
Industriell werden Aminosäuren heute nach folgenden Verfahren hergestellt:
- Extraktionsmethode: Hierzu werden Proteine zunächst mit Säuren hydrolysiert. Nach Fällung des Aminosäuregemischs aus dem Hydrolysat erfolgt eine Trennung chromatographisch mit Hilfe von Ionenaustauschern, wobei bei der Elution die unterschiedlichen Polaritäten der Aminosäuren ausgenutzt werden.
- Chemische Synthese: Es gibt eine Vielzahl von Synthesemethoden. Beispiele sind die Strecker-Synthese von D,L-Valin, die Degussa-Synthese von D,L-Cystein und die Synthese von D,L-Methionin aus Methylmercaptan, Acrolein und Blausäure. Da die Aminosäuren als Racemat vorliegen, müssen anschließend noch Verfahren zur Enantiomerentrennung erfolgen.
- Enzymatische Verfahren: Dieses Verfahren hat den Vorteil enantiomerenreine L- oder D-Aminosäuren mit geeigneten Enzymen als Biokatalysatoren zu liefern. Beispiele sind die Herstellung von L-Asparaginsäure aus Fumarsäure mit L-Aspartase und die Herstellung von L-Tryptophan aus Indol und Brenztraubensäure mit Tryptopharase.
- Fermentationsverfahren: Bei der Fermentation werden die Aminosäuren mit Hilfe geeigneter Mikroorganismen hergestellt. Der Syntheseprozess läuft dabei über sehr komplexe Zwischenschritte innerhalb der Zellen ab. Ein Beispiel ist die Herstellung von L-Glutaminsäure aus Glucose. Hierbei kann man aus 1 kg Glucose 0,5 kg Glutaminsäure gewinnen.
Allgemeiner Aufbau der Aminosäuren
(R bezeichnet die Seitenkette)
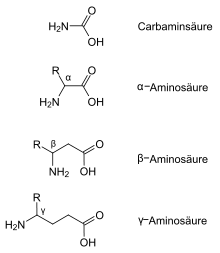
Die instabile Carbamidsäure ist keine Aminosäure, sondern ein Carbonsäureamid. Genau genommen ist sie das Monoamid der Kohlensäure. Alle Aminosäuren bestehen aus mindestens zwei Kohlenstoffatomen. Dabei entscheidet das Kohlenstoffatom, an dem sich die Aminogruppe befindet, um welche Klasse von Aminosäuren es sich handelt. Sind im Molekül mehrere Aminogruppen vertreten, so bestimmt dasjenige Kohlenstoff, dessen Aminogruppe dem Carboxy-Kohlenstoff am nächsten steht, um welche Klasse von Aminosäuren es sich handelt.
- α-Aminosäuren: Die Aminogruppe der α-Aminosäuren befindet sich am
zweiten Kohlenstoffatom, einschließlich des Carboxy-Kohlenstoffatoms. Die
Zählung beginnt immer mit dem Carboxy-Kohlenstoff. Die IUPAC-Bezeichnung
lautet daher 2-Aminocarbonsäuren. Der einfachste Vertreter der α-Aminosäuren
ist die proteinogene Aminosäure Glycin.
Der Begriff Aminosäuren wird meist synonym für eine Gruppe von α-Aminosäuren verwendet, die hauptsächlich aus L-α-Aminosäuren besteht: die proteinogenen Aminosäuren. Die proteinogenen Aminosäuren sind die Bausteine sämtlicher Proteine allen Lebens auf der Erde und neben den Nukleinsäuren Grundbausteine des Lebens. - β-Aminosäuren: Die Aminogruppe der β-Aminosäuren befindet sich am dritten Kohlenstoffatom (das Carboxy-Kohlenstoffatom mitgezählt). Die IUPAC-Bezeichnung lautet 3-Aminocarbonsäuren. Der einfachste Vertreter ist β-Alanin.
- γ-Aminosäuren: Die Aminogruppe der γ-Aminosäuren befindet sich am vierten Kohlenstoffatom (das Carboxy-Kohlenstoffatom mitgezählt). Die IUPAC-Bezeichnung lautet 4-Aminocarbonsäuren. Der einfachste Vertreter ist γ-Aminobuttersäure (GABA).
Die Bezeichnung weiterer Klassen der Aminosäuren ergibt sich nach dem gleichen Schema.
Die Aminosäuren einer Klasse unterscheiden sich durch ihre Seitenkette R. Ist die Seitenkette R verschieden von den anderen Substituenten, die sich am Kohlenstoff mit der Amino-Gruppe befinden, so befindet sich hier ein Stereozentrum und es existieren von der entsprechenden Aminosäure zwei Enantiomere. Enthält die Seitenkette R selbst weitere Stereozentren, so ergeben sich auch Diastereomere und die Zahl möglicher Stereoisomerer nimmt entsprechend zur Anzahl der weiteren Stereozentren zu. Von Aminosäuren mit zwei verschieden substituierten Stereozentren gibt es vier Stereoisomere.
Säure- und Base-Verhalten
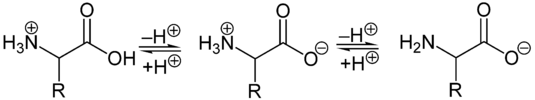
Als Feststoffe und in neutralen wässrigen Lösungen liegen Aminosäuren als Zwitterionen vor, das heißt die Aminogruppe ist protoniert und die Carboxygruppe ist deprotoniert. Verallgemeinert lässt sich das Zwitterion so darstellen:
Als Zwitterion kann die protonierte Aminogruppe als Säure (Protonendonator) und die Carboxylatgruppe kann als Base (Protonenakzeptor) reagieren. In sauren Lösungen liegen Aminosäuren als Kationen und in basischen Lösungen als Anionen vor:
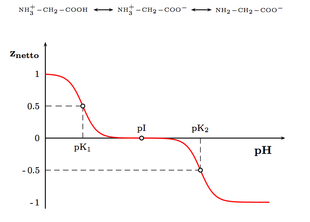
Die Ladung eines Aminosäuremoleküls hängt also vom pH-Wert der Lösung ab. Bei einem Zwitterion ist die Gesamtladung des Moleküls gleich null. Der entsprechende pH-Wert wird als isoelektrischer Punkt (pHI, pI) einer Aminosäure bezeichnet. Am isoelektrischen Punkt ist die Wasserlöslichkeit einer Aminosäure am geringsten.
Proteinogene Aminosäuren
Als proteinogene Aminosäuren werden alle Aminosäuren bezeichnet, die die Bausteine der Proteine von Lebewesen sind. Dabei handelt es sich bei den proteinogenen Aminosäuren stets um α-Aminosäuren. Bis auf die Aminosäure Glycin sind alle proteinogenen Aminosäuren chiral: Es existieren von jeder dieser Aminosäuren zwei Enantiomere, in einigen Fällen (z. B. Hydroxyprolin) mehr. Dabei ist nur die L-Aminosäure proteinogen: der zum Aufbau der Proteine notwendige Apparat – das Ribosom, die tRNA, die Aminoacyl-tRNA Synthetase (diese belädt die tRNA mit Aminosäuren) und andere – sind selbst auch chiral und können nur die L-Variante erkennen.
D-Aminosäuren kommen in Lebewesen vereinzelt vor. Sie werden dann aber unabhängig vom proteinogenen Stoffwechsel synthetisiert und bleiben daher nichtproteinogen. Sie werden zum Beispiel in der bakteriellen Zellwand und kurzen bakteriellen Peptiden wie Valinomycin (siehe Carrier) eingebaut. Ein Beispiel dafür ist D-Alanin.
Kanonische Aminosäuren
20 der proteinogenen Aminosäuren werden durch Codons des genetischen Materials codiert. Sie werden daher als kanonische Aminosäuren oder auch als Standardaminosäuren bezeichnet.
Die kanonische Aminosäure Prolin besitzt, im Gegensatz zu den anderen kanonischen Aminosäuren, keine primäre, sondern eine sekundäre Aminogruppe, und wird daher auch als sekundäre Aminosäure, fälschlicherweise bzw. veraltet oft auch als Iminosäure, bezeichnet.
In Aminosäuresequenzen werden die Aminosäuren meist im Einbuchstabencode oder im Dreibuchstabencode dargestellt.
| Aminosäure | Dreibuchstabencode | Einbuchstabencode | Acyl-Gruppe | Bemerkung | Ø in Proteinen |
|---|---|---|---|---|---|
| Alanin | Ala | A | Alanyl- | nicht-essentiell | 9,0 % |
| Arginin | Arg | R | Arginyl- | semi-essentiell | 4,7 % |
| Asparagin | Asn | N | Asparaginyl- | nicht-essentiell | 4,4 % |
| Asparaginsäure | Asp | D | α-Aspartyl- | nicht-essentiell | 5,5 % |
| Cystein | Cys | C | Cysteinyl- | nicht-essentiell* | 2,8 % |
| Glutamin | Gln | Q | Glutaminyl- | nicht-essentiell | 3,9 % |
| Glutaminsäure | Glu | E | α-Glutamyl- | nicht-essentiell | 6,2 ;% |
| Glycin | Gly | G | Glycyl- | nicht-essentiell | 7,5 % |
| Histidin | His | H | Histidyl- | semi-essentiell | 2,1 % |
| Isoleucin | Ile | I | Isoleucyl- | essentiell | 4,6 % |
| Leucin | Leu | L | Leucyl- | essentiell | 7,5 % |
| Lysin | Lys | K | Lysyl- | essentiell | 7,0 % |
| Methionin | Met | M | Methionyl- | essentiell | 1,7 % |
| Phenylalanin | Phe | F | Phenylalanyl- | essentiell | 3,5 % |
| Prolin | Pro | P | Prolyl- | nicht-essentiell | 4,6 % |
| Serin | Ser | S | Seryl- | nicht-essentiell | 7,1 % |
| Threonin | Thr | T | Threonyl- | essentiell | 6,0 % |
| Tryptophan | Trp | W | Tryptophyl- | essentiell | 1,1 % |
| Tyrosin | Tyr | Y | Tyrosyl- | nicht-essentiell* | 3,5 % |
| Valin | Val | V | Valyl- | essentiell | 6,9 % |
| *Für Kinder und Schwangere essentiell. | |||||
Zusätzlich zu den oben angegebenen Codes existieren Platzhalter, die benutzt werden, wenn aus der Proteinsequenzierung oder Röntgenstrukturanalyse nicht auf die genaue Aminosäure geschlossen werden kann.
| Dreibuchstabencode | Einbuchstabencode | |
|---|---|---|
| Asparagin oder Asparaginsäure | Asx | B |
| Glutamin oder Glutaminsäure | Glx | Z |
| Leucin oder Isoleucin | Xle | J |
| unbekannte Aminosäure | Xaa (selten Unk) | X |
Nichtkanonische Aminosäuren
Zu den natürlich vorkommenden nichtkanonischen Aminosäuren gehören alle anderen proteinogenen Aminosäuren. Diese wiederum können in drei Klassen eingeteilt werden:
- Zur ersten Klasse gehören die Aminosäuren, die durch eine Recodierung des genetischen Materials in Proteine eingebaut werden. Die 21. und die 22. proteinogene Aminosäure – Selenocystein und Pyrrolysin – gehören zu dieser Klasse. Es wird vermutet, dass diese Aminosäuren wahrscheinlich keine eigene kanonische tRNA haben, sondern sich ihre tRNA von den kanonischen tRNAs ableitet (siehe Selenocystein). Die Aminosäuren dieser Klasse werden nicht von allen Organismen verwendet.
| Aminosäure | Dreibuchstabencode | Einbuchstabencode |
|---|---|---|
| Pyrrolysin | Pyl | O |
| Selenocystein | Sec | U |
- Zur zweiten Klasse gehören die Aminosäuren, die aus kanonischen Aminosäuren entstehen, deren Aminosäurerest R nach dem Einbau in Proteine verändert wird. So kann beispielsweise Prolin zu Hydroxyprolin, Serin zu O-Phosphoserin, Tyrosin zu O-Phosphotyrosin und Glutamat zu γ-Carboxyglutamat umgewandelt werden. Eine wichtige Änderung des Aminosäurerestes stellt auch die Glykosylierung dar: hier werden Kohlenhydratreste auf die Aminosäurereste übertragen, wodurch Glykoproteine entstehen.
- Zur dritten Klasse gehören die Aminosäuren, die der Organismus nicht von den kanonischen Aminosäuren unterscheiden kann und die er deshalb anstelle dieser in Proteine unspezifisch einbaut. Dazu gehört beispielsweise Selenomethionin, das anstelle des Methionin eingebaut werden kann, das Canavanin, das der Organismus nicht vom Arginin unterscheiden kann oder die Azetidin-2-carbonsäure, die als Prolin-Analogon wirkt. Viele der proteinogenen Aminosäuren dieser Klasse sind toxisch, da sie oft zu einer Fehlfaltung des Proteins führen, wodurch die Funktionsfähigkeit des Proteins beeinträchtigt werden kann. So ist Azetidin-2-carbonsäure ein toxischer Bestandteil des Maiglöckchens, wobei sich das Maiglöckchen mit einer hochspezifischen Prolyl-tRNA-Synthetase vor dem unkontrollierten Einbau dieser Aminosäure schützt. Wegen ihrer oft toxischen Wirkung werden diese Aminosäuren oft nicht zu den proteinogenen Aminosäuren gezählt, zu denen sie jedoch per definitionem gehören.
Der Mensch selbst nutzt die 20 kanonischen Aminosäuren sowie Selenocystein. Von den 20 kanonischen Aminosäuren werden 12 vom menschlichen Organismus bzw. durch im menschlichen Verdauungstrakt lebende Mikroorganismen synthetisiert. Die restlichen 8 Aminosäuren sind für den Menschen essentiell, das heißt er muss sie über die Nahrung aufnehmen.
Der Einbau künstlicher, nahezu beliebig gebauter Aminosäuren über die Ersetzung des Liganden in der entsprechenden tRNA-Synthetase ist so weit fortgeschritten, dass damit gezielt bestimmte Proteine eine Markierung erhalten können, die das Protein nach Behandlung mit spezifischen Reagenzien zur Fluoreszenz anregen (Beispiel: Einbau von Norbornen-Aminosäure via Pyrrolysyl-tRNA-Synthetase/Codon CUA). Damit ist eine genaue Lokalisierung des Proteins auch ohne Produktion und Reaktion mit Antikörpern möglich.
Biochemische Bedeutung
Aminosäuren als Bausteine von Proteinen
L-Aminosäuren sind in der Biochemie von großer Bedeutung, da sie die Bausteine von Peptiden und Proteinen (Eiweißen) sind. Im Allgemeinen werden in der Literatur zwanzig so genannte proteinogene Aminosäuren genannt, das heißt solche, die im Genom für Proteine codiert sind, allerdings sind in letzter Zeit zwei weitere (Selenocystein und Pyrrolysin) hinzugekommen. Bei diesen handelt es sich stets um α-Aminosäuren, da die Aminogruppe am unmittelbar benachbarten Kohlenstoffatom, welches die funktionelle Carboxygruppe trägt, (Cα) gebunden ist. Diese 20 L-Aminosäuren werden durch je drei Nukleinbasen in der DNA codiert. Darüber hinaus gibt es noch weitere Aminosäuren, die Bestandteile von Proteinen sind, jedoch nicht codiert werden.
Aminosäureketten werden in Abhängigkeit von ihrer Länge als Peptide oder Proteine bezeichnet. Aminosäureketten mit einer Länge von unter zirka 100 Aminosäuren werden meist noch als Peptide bezeichnet, erst ab einer größeren Kettenlänge spricht man von Proteinen. Die einzelnen Aminosäuren sind dabei innerhalb der Kette über die so genannte Peptidbindung (Säureamid) verknüpft. Ein automatisiertes Verfahren zur Synthese von Peptiden liefert die Merrifield-Synthese.
In Form von Nahrung aufgenommene Proteine werden bei der Verdauung in L-Aminosäuren zerlegt. In der Leber werden sie weiter verwertet. Entweder werden sie zur Proteinbiosynthese verwendet oder abgebaut. Die wichtigsten Mechanismen des Aminosäurenabbaus sind:
- Transaminierung
- Desaminierung
- Decarboxylierung
Essentielle Aminosäuren
Aminosäuren, die ein tierischer Organismus benötigt, jedoch nicht selbst herstellen kann, heißen essentielle Aminosäuren und müssen mit der Nahrung aufgenommen werden. Alle essentiellen Aminosäuren sind L-α-Aminosäuren. Für Menschen sind Valin, Methionin, Leucin, Isoleucin, Phenylalanin, Tryptophan, Threonin und Lysin essentielle Aminosäuren. Semi-essentielle Aminosäuren müssen nur in bestimmten Situationen mit der Nahrung aufgenommen werden, zum Beispiel während des Wachstums oder bei schweren Verletzungen. Die übrigen Aminosäuren werden entweder direkt synthetisiert oder aus anderen Aminosäuren durch Modifikation gewonnen. Cystein kann aus der essentiellen Aminosäure Methionin synthetisiert werden. Für Kinder ist zusätzlich zu den generell essentiellen Aminosäuren Tyrosin essentiell, da in diesem Lebensalter die Körperfunktion zu dessen Herstellung aus Phenylalanin noch nicht ausgereift ist. Es gibt auch Erkrankungen, die den Aminosäurestoffwechsel beeinträchtigen, dann müssen unter Umständen eigentlich nicht-essentielle Aminosäuren dennoch mit der Nahrung aufgenommen werden. Hühnereier zum Beispiel enthalten alle essentiellen bzw. semi-essentiellen Aminosäuren, die der menschliche Körper benötigt.
.png)
Pflanzen und Mikroorganismen können alle für sie notwendigen Aminosäuren selbst synthetisieren. Daher gibt es für sie keine essentiellen Aminosäuren.
Chemisch-physikalische Eigenschaften
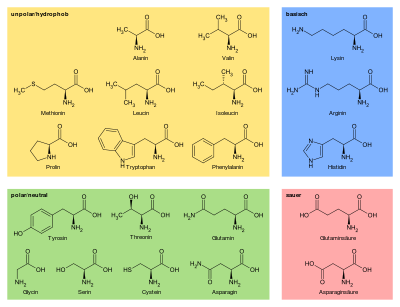
Die proteinogenen Aminosäuren lassen sich nach ihren Resten in Gruppen aufteilen (siehe Tabellenübersicht der Eigenschaften). Dabei kann eine Aminosäure in verschiedenen Gruppen gleichzeitig auftauchen. In einem Mengendiagramm lassen sich die Überlappungen der Gruppen grafisch darstellen.
Die Eigenschaften der Seitenkette von Cystein betreffend haben die Autoren unterschiedliche Ansichten: Löffler hält sie für polar, während Alberts sie für unpolar hält. Richtigerweise handelt es sich bei Schwefel um ein Heteroatom, folglich gilt: Die Seitenkette von Cystein hat schwach polare Eigenschaften.
Säure- und Basen-Verhalten
Für das Säure-Base-Verhalten proteinogener Aminosäuren ist vor allem das Verhalten der Seitenkette der Aminosäure (fortan mit R bezeichnet) interessant. In Proteinen sind die NH2- und COOH-Gruppen bei physiologischen pH-Wert (um pH 7) wegen der Peptidbindung nicht protonierbar und damit auch nicht titrierbar. Die Ausnahme ist der Amino- und der Carboxy-Terminus des Proteins. Daher ist für das Säure-Base-Verhalten von Proteinen und Peptiden der Seitenkettenrest R maßgeblich.
Das Verhalten der Seitenkette R hängt von ihrer Konstitution ab, das heißt ob die Seitenkette selbst wieder als Protonenakzeptor oder -donator wirken kann. Die proteinogenen Aminosäuren werden nach den funktionellen Gruppen in unpolare oder polare Aminosäureseitenketten eingeteilt und weiter (in nach Polarität sortierte Untergruppen) in aliphatische, aromatische, amidierte, Schwefel-enthaltende, hydroxylierte, basische und saure Aminosäuren unterteilt. Die Seitenketten von Tyrosin und Cystein sind zwar im Vergleich zu den anderen unpolaren Seitenketten relativ sauer, neigen aber erst bei unphysiologisch hohen pH-Werten zum Deprotonieren. Prolin ist eine sekundäre Aminosäure, da der N-Terminus mit der Seitenkette einen fünfatomigen Ring schließt. Innerhalb eines Proteins bindet der Carboxy-Terminus einer vorhergehenden Aminosäure an den Stickstoff des Prolins, welcher aufgrund der bereits erwähnten Peptidbindung nicht protonierbar ist. Histidin, Tyrosin und Methionin kommen jeweils in zwei Untergruppen vor.
| Aminosäure | Bezeichnung | frei | im Protein |
|---|---|---|---|
| Asp | sauer | 3,68 | 3,7–4,0 |
| Glu | sauer | 4,25 | 4,2–4,5 |
| His | basisch | 6,0 | 6,7–7,1 |
| Cys | semisauer | 8,33 | 8,8–9,1 |
| Tyr | semisauer | 10,07 | 9,7–10,1 |
| Lys | basisch | 10,53 | 9,3–9,5 |
| Arg | basisch | 12,48 | – |
Aliphatische Aminosäureseitenketten
- Alanin
- Glycin
- Isoleucin
- Leucin
- Methionin
- Prolin
- Valin
Aromatische Aminosäureseitenketten
- Histidin
- Phenylalanin
- Tryptophan
- Tyrosin
Amidierte Aminosäureseitenketten
- Asparagin
- Glutamin
Schwefel-enthaltende Aminosäureseitenketten
- Cystein
- Methionin
Hydroxylierte Aminosäureseitenketten
- Serin
- Threonin
- Tyrosin
Basische Aminosäureseitenketten
- Lysin
- Arginin
- Histidin
Saure Aminosäureseitenketten
- Asparaginsäure (in Wasser dissoziiert zu Aspartat)
- Glutaminsäure (in Wasser dissoziiert zu Glutamat)
Der pK-Wert ist der pH-Wert, bei dem die titrierbaren Gruppen zu gleichen Teilen protoniert und deprotoniert vorliegen. D.h., die titrierbare Gruppe liegt zu gleichen Teilen in ihrer basischen, wie in ihrer sauren Form vor (siehe auch: Henderson-Hasselbalch-Gleichung).
Es ist meist üblich, anstatt vom pKS vom pK zu sprechen, das heißt vom pK der Säure. In diesem Sinne müsste allerdings vom pK des Lysins als pKB, also vom pK der Base gesprochen werden. Aus Gründen der Vereinfachung wird diese Notation aber allgemein weggelassen, da sie sich auch aus dem Sinnzusammenhang selbst ergibt (d.h. ob die Gruppe als Base oder Säure wirkt).
Der pK ist keine Konstante, sondern hängt von der Temperatur, der Aktivität, der Ionenstärke und der unmittelbaren Umgebung der titrierbaren Gruppe ab und kann daher stark schwanken.
Ist der pH höher als der pK einer titrierbaren Gruppe, so liegt die titrierbare Gruppe in ihrer basischen (deprotonierten) Form vor. Ist der pH niedriger als der pK der titrierbaren Gruppe, so liegt die titrierbare Gruppe in ihrer sauren (protonierten) Form vor:
- für Asp (pK = 3,86) bei pH 7: die Seitenkette ist nahezu vollständig deprotoniert
- für Lys (pK= 10,53) bei pH 7: die Seitenkette ist nahezu vollständig protoniert
Die Seitenketten basischer Aminosäuren sind in ihrer protonierten (sauren) Form einfach positiv geladen und in ihrer deprotonierten (basischen) Form ungeladen. Die Seitenketten der sauren Aminosäuren (einschließlich Cystein und Tyrosin) sind in ihrer protonierten (sauren) Form ungeladen und in ihrer deprotonierten (basischen) Form einfach negativ geladen. Deswegen spielt der pH-Wert für die Eigenschaften der Seitenkette eine so wichtige Rolle, da das Verhalten der Seitenkette ein ganz anderes ist, wenn sie geladen bzw. ungeladen ist.
Die titrierbaren Seitenketten beeinflussen zum Beispiel das Löslichkeitsverhalten der entsprechenden Aminosäure. In polaren Lösungsmitteln gilt: geladene Seitenketten machen die Aminosäure löslicher, ungeladene Seitenketten machen die Aminosäure unlöslicher.
In Proteinen kann das dazu führen, dass bestimmte Abschnitte hydrophiler oder hydrophober werden, wodurch die Faltung und damit die Aktivität von Enzymen vom pH-Wert abhängt. Durch stark saure oder basische Lösungen können Proteine deswegen auch denaturiert werden.
| Aminosäure | pK2COOH | pK1COOH | Isoelektrischer Punkt |
pK1NH2 | pK2NH2 |
|---|---|---|---|---|---|
| Alanin | – | 2,3 | 6,1 | 9,9 | – |
| Arginin | – | 2,81 | 11,76 | 9,09 | 13,2 |
| Asparagin | – | 2,02 | 5,41 | 8,80 | – |
| Asparaginsäure | 3,65 | 1,88 | 2,85 | 9,60 | – |
| Cystein | 8,33* | 1,71 | 5,05 | 10,78 | – |
| Glutamin | – | 2,17 | 5,65 | 9,13 | – |
| Glutaminsäure | 4,25 | 2,19 | 3,22 | 9,67 | – |
| Glycin | – | 2,21 | 5,97 | 9,15 | – |
| Histidin | – | 1,78 | 7,47 | 8,97 | 5,97 |
| Isoleucin | – | 2,32 | 5,94 | 9,76 | – |
| Leucin | – | 2,4 | 5,98 | 9,6 | – |
| Lysin | – | 2,20 | 9,59 | 8,90 | 10,28 |
| Methionin | – | 2,28 | 5,74 | 9,21 | – |
| Phenylalanin | – | 2,58 | 5,84 | 9,24 | – |
| Prolin | – | 1,99 | 6,3 | 10,60 | – |
| Serin | – | 2,21 | 5,68 | 9,15 | – |
| Threonin | – | 2,10 | 5,60 | 9,12 | – |
| Tryptophan | – | 2,15 | 5,64 | 9,12 | – |
| Tyrosin | 10,07** | 2,20 | 5,66 | 9,11 | – |
| Valin | – | 2,30 | 5,96 | 9,60 | – |
| * Thiolgruppe ** phenolische Hydroxygruppe | |||||
Tabellenübersicht der Eigenschaften
| Aminosäure | Abk. | Code | Aminosäure-Seitenkette (R) | Charakter von R | Molare Masse von R (g/mol) | van-der-Waals-Volumen von R | Polarität von R | Hydro- phobi- zität von R |
Acidität oder Basizität von R | Säure-Konstante
(pKs) von R |
Struktur- formel |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Alanin | Ala | A | –CH3 | aliphatisch | 15,03 | 67 | unpolar | 1,8 | neutral | – |
|
| Arginin | Arg | R | –CH2CH2CH2NH-C(NH)NH2 | aliphatisch | 100,14 | 148 | polar | −4,5 | basisch (stark) | 12,48 |
|
| Asparagin | Asn | N | –CH2CONH2 | aliphatisch | 58,06 | 96 | polar | −3,5 | neutral | – |
|
| Asparaginsäure | Asp | D | –CH2COOH | aliphatisch | 59,04 | 91 | polar | −3,5 | sauer | 3,90 |
|
| Cystein | Cys | C | –CH2SH | aliphatisch | 47,10 | 86 | polar | 2,5 | neutral | 8,18 |
|
| Glutamin | Gln | Q | –CH2CH2CONH2 | aliphatisch | 72,09 | 114 | polar | −3,5 | neutral | – |
|
| Glutaminsäure | Glu | E | –CH2CH2COOH | aliphatisch | 73,07 | 109 | polar | −3,5 | sauer | 4,07 |
|
| Glycin | Gly | G | –H | aliphatisch | 1,01 | 48 | unpolar | −0,4 | neutral | – |
|
| Histidin | His | H | –CH2(C3H3N2) | aromatisch | 81,1 | 118 | polar | −3,2 | basisch (schwach) | 6,04 |
|
| Isoleucin | Ile | I | –CH(CH3)CH2CH3 | aliphatisch | 57,11 | 124 | unpolar | 4,5 | neutral | – |
|
| Leucin | Leu | L | –CH2CH(CH3)2 | aliphatisch | 57,11 | 124 | unpolar | 3,8 | neutral | – |
|
| Lysin | Lys | K | –CH2CH2CH2CH2NH2 | aliphatisch | 72,13 | 135 | polar | −3,9 | basisch | 10,54 |
|
| Methionin | Met | M | –CH2CH2SCH3 | aliphatisch | 75,15 | 124 | unpolar | 1,9 | neutral | – |
|
| Phenylalanin | Phe | F | –CH2(C6H5) | aromatisch | 91,13 | 135 | unpolar | 2,8 | neutral | – |
|
| Prolin | Pro | P | –CH2CH2CH2– | heterocyclisch | 42,08 | 90 | unpolar | −1,6 | neutral | – |
|
| Serin | Ser | S | –CH2OH | aliphatisch | 31,03 | 73 | polar | −0,8 | neutral | – |
|
| Threonin | Thr | T | –CH(OH)CH3 | aliphatisch | 45,06 | 93 | polar | −0,7 | neutral | – |
|
| Tryptophan | Trp | W | –CH2(C8H6N) | aromatisch | 130,16 | 163 | unpolar | −0,9 | neutral | – |
|
| Tyrosin | Tyr | Y | –CH2(C6H4)OH | aromatisch | 107,13 | 141 | polar | −1,3 | neutral | 10,46 |
|
| Valin | Val | V | –CH(CH3)2 | aliphatisch | 43,09 | 105 | unpolar | 4,2 | neutral | – |
|
Stereochemie
18 der 20 proteinogenen Aminosäuren haben gemäß der Cahn-Ingold-Prelog-Konvention am α-Kohlenstoff-Atom die (S)-Konfiguration, lediglich Cystein besitzt die (R)-Konfiguration, da hier der Kohlenstoff mit der Thiolgruppe eine höhere Priorität als die Carbonsäuregruppe hat. Glycin ist nicht chiral, daher kann keine absolute Konfiguration bestimmt werden.
Zusätzlich zum Stereozentrum am α-C-Atom besitzen Isoleucin und Threonin in ihrem Rest R je ein weiteres stereogenes Zentrum. Proteinogenes Isoleucin [R = –C*H(CH3)CH2CH3] ist dort (S)-konfiguriert, Threonin [R = –C*H(OH)CH3] (R)-konfiguriert.
Nichtproteinogene Aminosäuren
Von den nichtproteinogenen, das heißt nicht in Proteinen vorkommenden, Aminosäuren sind bislang über 400 bekannt, die in Organismen vorkommen. Dazu gehört etwa das L-Thyroxin, ein Hormon der Schilddrüse, L-DOPA, L-Ornithin oder das in fast allen Arten von Cyanobakterien nachgewiesene Neurotoxin β-Methylaminoalanin (BMAA). Die L-Azetidin-2-carbonsäure ist ein toxischer Bestandteil der Rhizome einheimischer Maiglöckchen (Convallaria majalis) und Zuckerrüben. Sie wirkt hemmend auf das Pflanzenwachstum.
Die meisten nichtproteinogenen Aminosäuren leiten sich von den proteinogenen ab, die L-α-Aminosäuren sind. Dennoch können dabei auch β-Aminosäuren (β-Alanin) oder γ-Aminosäuren (GABA) entstehen.
Zu den nichtproteinogenen Aminosäuren zählen auch alle D-Enantiomere der proteinogenen L-Aminosäuren. D-Serin wird im Hirn durch die Serin-Racemase aus L-Serin (seinem Enantiomer) erzeugt. Es dient sowohl als Neurotransmitter als auch als Gliotransmitter durch die Aktivierung des NMDA-Rezeptors, was zusammen mit Glutamat die Öffnung des Kanals erlaubt. Zum Öffnen des Ionenkanals muss Glutamat und entweder Glycin oder D-Serin binden. D-Serin ist an der Glycin-Bindungsstelle des Glutamatrezeptors vom NMDA-Typ ein stärkerer Agonist als Glycin selbst, war aber zum Zeitpunkt der Erstbeschreibung der Glycin-Bindungsstelle noch unbekannt. D-Serin ist nach D-Aspartat die zweite D-Aminosäure, die in Menschen gefunden wurde.
Zu den synthetischen Aminosäuren gehört die 2-Amino-5-phosphonovaleriansäure (APV), ein Antagonist des NMDA-Rezeptors und das ökonomisch wichtige D-Phenylglycin [Synonym: (R)-Phenylglycin], das in der Seitenkette vieler semisynthetischer β-Lactamantibiotica als Teilstruktur enthalten ist. (S)- und (R)-tert-Leucin (Synonym: (S)- und (R)-β-Methylvalin) sind synthetische Strukturisomere der proteinogenen Aminosäure (S)-Leucin und werden als Edukt in stereoselektiven Synthesen eingesetzt.
Es gibt auch α-Aminosulfonsäuren [Beispiel: 2-Aminoethansulfonsäure (Synonym: Taurin)], α-Aminophosphonsäuren und α-Aminophosphinsäuren. Das sind auch α-Aminosäuren, jedoch keine α-Aminocarbonsäuren. Statt einer Carboxygruppe (–COOH) ist eine Sulfonsäure-, Phosphonsäure- bzw. Phosphinsäuregruppe in diesen α-Aminosäuren enthalten.
| Aminosäure | Biologische Bedeutung |
|---|---|
| Thyroxin | Hormon der Schilddrüse |
| GABA | inhibitorischer Neurotransmitter |
| L-Homoserin | Stoffwechselzwischenprodukt der Argininsynthese |
| Ornithin | Stoffwechselzwischenprodukt im Harnstoffzyklus |
| Citrullin | Stoffwechselzwischenprodukt im Harnstoffzyklus |
| Argininosuccinat | Stoffwechselzwischenprodukt im Harnstoffzyklus |
| L-DOPA | Stoffwechselzwischenprodukt bei der Synthese von Katecholaminen |
| 5-Hydroxytryptophan | Stoffwechselzwischenprodukt bei der Serotoninsynthese |
| β-Alanin | Baustein von Coenzym A |
| β-Methylamino-Alanin | Neurotoxin in Cyanobakterien |
| Ibotensäure | Pilzgift |
| D-Valin | Bestandteil des Antibiotikums Valinomycin |
| D-Alanin | Bestandteil in bakteriellen Zellwänden |
| D-Glutamat | Bestandteil in bakteriellen Zellwänden |
| 2,6-Diaminopimelinsäure | Bestandteil in bakteriellen Zellwänden |
Verwendung
Aminosäuren haben für die Ernährung des Menschen eine fundamentale Bedeutung. In der Regel wird der Bedarf an essentiellen Aminosäuren durch tierische oder eine geeignete Kombination verschiedener pflanzlicher Proteine (etwa aus Getreide und Hülsenfrüchten) vollkommen gedeckt. Pflanzliche Proteine haben meist eine geringere biologische Wertigkeit. Futtermittel in der Nutztierhaltung werden zusätzlich mit Aminosäuren, z.B. DL-Methionin und L-Lysin, angereichert, wodurch deren Nährwert erhöht wird.
Aminosäuren bzw. ihre Derivate finden Verwendung als Zusatz für Lebensmittel, hier insbesondere auch als Geschmacksverstärker (Natriumglutamat), Süßstoff (Aspartam), und sind Vorstufen für bestimmte Aromastoffe, die bei der Zubereitung von Speisen durch die Maillard-Reaktion entstehen.
In der Pharmazie bzw. Medizin werden L-Aminosäure-Infusionslösungen für die parenterale Ernährung angewendet. Daneben werden Aminosäuren auch als Hilfsstoffe eingesetzt, z.B. als Salzbildner, Puffer und Stabilisatoren bei bestimmten Lebererkrankungen. Bei Krankheiten mit einem Mangel von Neurotransmittern verwendet man L-Dopa. Für synthetische Peptidhormone und für die Biosynthese von Antibiotika sind Aminosäuren notwendige Ausgangsstoffe. Magnesium- und Kalium-Aspartate spielen bei der Behandlung von Herz- und Kreislauferkrankungen eine Rolle. Cystein, beziehungsweise die Derivate Acetylcystein und Carbocystein, finden zudem eine Anwendung bei infektiösen Bronchialerkrankungen mit erhöhtem Bronchialsekret. Zudem wird L-Cystein als Reduktionsmittel in der Dauerwelle eingesetzt.
Aminosäuren werden in der Kosmetik Hautpflegemitteln und Shampoos zugesetzt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 03.09. 2025