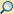DNA-Reparatur
| Übergeordnet |
|---|
| DNA-Metabolismus |
| Untergeordnet |
| Einzelstrangbruch-Reparatur Doppelstrangbruch-Reparatur Postreplikations-Reparatur Virale DNA-Reparatur mitochondrielle DNA-Reparatur Pyrimidindimer-Reparatur Basen-Exzisionsreparatur Nukleotid-Exzisionsreparatur |
| Gene Ontology |
| QuickGO |
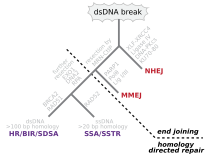
Durch Mechanismen der DNA-Reparatur (Desoxyribonukleinsäure-Reparatur) können Zellen DNA-Schäden beseitigen. Solche Schäden in der DNA können spontan im Verlauf der DNA-Replikation oder durch die Einwirkung mutagener Substanzen, extremer Wärme oder ionisierender Strahlung verursacht werden.
DNA-Schäden können dazu führen, dass die Replikation der DNA für die Mitose falsch erfolgt, Proteine nicht mehr bzw. falsch synthetisiert oder wichtige Chromosomenbereiche nach Doppelstrangbrüchen abgespalten werden.
Bringen die komplexen Reparaturmechanismen der Zelle keinen Erfolg, so sammeln sich in wachsenden und ruhenden somatischen Zellen so viele Fehler an, dass die normalen Zellfunktionen gestört sind. In einer Keimzelle wären die Tochterzellen nicht mehr lebensfähig, was zu einer Inaktivierung der Zelllinie führt: die Zelle bzw. die zweite bis dritte nachfolgende Generation verliert ihre Teilungsfähigkeit und stirbt. Im Zuge der Zellzykluskontrolle können Kontrollproteine eine Zelle bzw. deren DNA als defekt erkennen und einen Zyklusarrest in der G0-Phase (Zellseneszenz) oder den programmierten Zelltod (Apoptose) einleiten.[1] Nichtreparierte DNA-Schäden in bestimmten Genen (Onkogene, Tumorsuppressorgene) können zu Krebs führen.
Einzelne DNA-Reparaturenzyme konnten inzwischen mit PAL-Mikroskopie bei ihrer Arbeit in einem Bakterium verfolgt und die entsprechenden Parameter bestimmt werden. So dauert beispielsweise in E. coli eine Basenexzisionsreparatur gut zwei Sekunden.[2] Für ihre Arbeiten zur DNA-Reparatur erhielten Tomas Lindahl, Paul Modrich und Aziz Sancar 2015 den Nobelpreis für Chemie.[3][4]
Ursachen von DNA-Schäden
Mögliche Ursachen sind Stoffwechselvorgänge, chemische Substanzen oder Ionisierende Strahlung, wie zum Beispiel UV-Strahlung, Elektronen oder Protonen. Sowohl DNA-Schäden als auch Fehler bei der Replikation und anderen zellulären Prozessen können zu Mutationen führen. Da für Mutationen eigene Reparaturmechanismen existieren, können sie hier ähnlich wie DNA-Schäden betrachtet werden.
Eine Zelle ist ein System im Fließgleichgewicht. Sie nimmt fortwährend Moleküle auf, verarbeitet sie, synthetisiert benötigte Stoffe, und gibt wiederum bestimmte Stoffe an die Umgebung ab. Beim normalen zellulären Metabolismus können reaktive Sauerstoffspezien (ROS, unter anderem Sauerstoffradikale) entstehen, welche ein signifikantes Ausmaß an oxidativen Schaden anrichten. Am häufigsten sind dies Basenschäden und Einzelstrangbrüche, weniger als 0,5 % sind Doppelstrangbrüche, welche auch noch relativ gleichförmig über die DNA verteilt sind. Die Wahrscheinlichkeit endogen induzierter Schadenscluster und damit – schwierig zu reparierender – gehäufter Läsionen (complex lesions), wie sie sonst durch die nicht-homogene Energieabgabe ionisierender Strahlen auftreten, ist sehr gering. Eine zu hohe Protonendichte und/oder zu hohe Temperatur kann Depurinierungen oder Depyrimidierung auslösen.
Arten von DNA-Schäden
- Basenmodifikationen
- Pyrimidindimere in der Regel 6–4-Photoprodukte (6-4PPs) oder Cyclobutan-Pyrimidindimere (CPDs)
- oxidierte Basen beispielsweise 8-Oxo-7,8-Dihydroguanin (8-oxoG) oder 8-Oxo-7,8-Dihydroadenin (8-oxoA)
- alkylierte Basen (z. B. Basenmethylierungen)
- andere Bulky lesions (sperrige Basenveränderungen)
- Basenfehlpaarungen durch fehlerhafte Replikation (Mismatch)
- Basenverlust – Apurinierungen oder Apyrimidierungen (AP sites)
- Veränderungen des Zuckergerüsts
- DNA-Protein-Vernetzungen (DNA protein crosslinks)
- DNA-DNA-Verknüpfungen (DNA crosslinks)
- Einzelstrangbrüche (ss breaks)
- Doppelstrangbrüche (ds breaks)
Die Behandlung mit einem Gray Röntgenstrahlung erzeugt pro Zelle etwa[5]
- 1000–2000 Basenmodifikationen
- 500–1000 Einzelstrangbrüche
- 800–1600 Veränderungen des Zuckergerüsts
- 150 DNA-Protein-Vernetzungen
- 50 Doppelstrangbrüche
DNA-Reparaturgene, die bei Krebs oft mutiert sind
| HR | NHEJ | SSA | FA | BER | NER | MMR | |
|---|---|---|---|---|---|---|---|
| ATM-Kinase | |||||||
| ATR-Kinase | |||||||
| PAXIP | |||||||
| RPA | |||||||
| BRCA1 | |||||||
| BRCA2 | |||||||
| RAD51 | |||||||
| RFC | |||||||
| XRCC1 | |||||||
| PCNA | |||||||
| PARP1 | |||||||
| ERCC1 | |||||||
| MSH3 |
HR = homologe Rekombination; NHEJ = non-homologous end joining;
SSA = single-strand annealing; FA = fanconi anemia pathway;
BER = base excision repair;
NER = nucleotide excision repair; MMR = mismatch repair
Reparatur von DNA-Schäden
Für die unterschiedlichen Arten von DNA-Schäden existieren unterschiedliche, spezialisierte Reparaturmechanismen. Einige Mechanismen sind beispielsweise auf die Reparatur von Schäden im DNA-Einzelstrang, andere auf die Reparatur von DNA-Doppelstrangbrüchen spezialisiert. Unterschiede bestehen auch zwischen Prokaryonten und Eukaryonten, die unterschiedliche DNA-Polymerasen besitzen.
| Mechanismus | DNA-Schaden | Genauigkeit | Quellen |
|---|---|---|---|
| Basenexzisionsreparatur (base excision repair, BER) | behebt Schäden durch Oxidation, Desaminierung und Alkylierung, die Einzelstrangbrüche erzeugen | genau | [6][7] |
| Nucleotidexzisionsreparatur (nucleotide excision repair, NER) | Endogene Schäden wie Cyclopurin, Thymindimere (Cyclobutandimere und Pyrimidin-(6-4)-pyrimidon-Photoprodukte) | genau | [8][9][10] |
| Homologie-gerichtete Reparatur (homology-directed repair, HDR) | Doppelstrangbrüche in der S-Phase oder G2-Phase des Zellzyklus | genau | [11] |
| Nichthomologe Endverknüpfung (non-homologous end joining, NHEJ) | Doppelstrangbrüche in der G0-Phase, der G1-Phase oder der G2-Phase des Zellzyklus | ungenau | [11] |
| Alternative Endverknüpfung (Microhomology-mediated end joining, MMEJ, oder alt-End joining) | Doppelstrangbrüche in der S-Phase des Zellzyklus | immer ungenau | [11] |
| Fehlpaarungsreparatur (DNA mismatch repair, MR) | Basenaustausche und Indel-basierte Fehlpaarungen aufgrund der DNA-Replikation | genau | [12] |
| Direkte Umkehr (direct reversal) | 6-O-Methylguanin wird durch die MGMT zurück in Guanin umgewandelt, manche DNA-Methylierungen werden durch AlkB entfernt | genau | [13] |
| Transläsionsynthese (translesion synthesis, TS) | Toleranz von DNA-Schaden, wodurch die DNA-Replikation nicht bei einem Schaden unterbricht | teilweise ungenau | [14] |
Einzelstrang-Schadensreparatur
Basenexzisionsreparatur (BER)
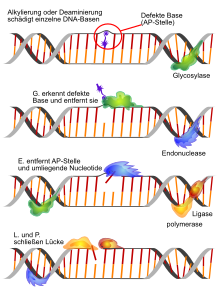
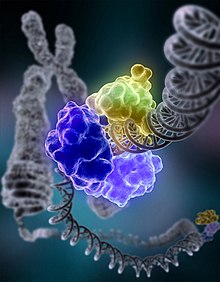
Bei der Basenexzisionsreparatur werden Fehler in Form oxidierter, alkylierter oder desaminierter einzelner Basen behoben. Dabei werden Schäden an den Basen durch eine jeweils spezifische DNA-Glykosylase erkannt und herausgeschnitten (Exzision). Diese wandert entlang der kleinen Furche und klappt die einzelnen Basen in ihr katalytisches Zentrum. Eine beschädigte Base wird von der DNA-Glykosylase entfernt, danach wird durch eine AP-Endonuklease (Apurinische/apyrimidinische-Endonuklease) ein Einzelstrangbruch im Zucker-Phosphat-Rückgrat eingeführt. Eine DNA-Polymerase synthetisiert abhängig von der komplementären Base auf dem fehlerfreien Strang die korrekte Base. Es existieren hier zwei Varianten der BER: short patch repair (eine einzelne Base wird ersetzt) und long patch repair (2–20 Nukleotide werden ersetzt). Beim Menschen ist die DNA-Polymerase β (Pol β) die hauptverantwortliche Polymerase. Eine DNA-Ligase verknüpft die neue Base im DNA-Strang, womit der Fehler korrigiert ist.
Nukleotidexzisionsreparatur (NER)
Im Unterschied zur Basenexzisionsreparatur werden von der Nukleotidexzisionsreparatur (NER) vor allem sogenannte „bulky lesions“ erkannt, also Stellen, die eine Art „Buckel“ im DNA-Molekül erzeugen und dadurch die Helixstruktur stören. Es kann sich dabei um Pyrimidindimere und 6,4 Photoprodukte handeln, welche durch UV-Strahlung erzeugt werden. Die Nukleotidexzisionsreparatur gliedert sich in die Schadenserkennung, das Einschneiden, das Herausschneiden eines 25–30 Basen langen DNA-Abschnitts, die Neusynthese dieses Abschnittes und die anschließende Ligation.
NER kommt sowohl bei Pro- als auch bei Eukaryoten vor, jedoch unterscheiden sich die Mechanismen und beteiligten Enzyme. Während bei Prokaryonten wie Escherichia coli Uvr Proteine und DNA-Polymerase I beteiligt sind, sind es bei Eukaryonten Proteine, die ihre Namen von den Erbkrankheiten Xeroderma pigmentosum und Cockayne-Syndrom haben, z. B. XPA bzw. CSA. Zu den beteiligten Polymerasen gehören die DNA-Polymerasen δ, ε und/oder κ.
Bei Eukaryonten gibt es zwei Wege der Nukleotidexzisionsreparatur. Zum einen Global Genome Repair (GGR), welche Schäden in transkriptionsinaktiven Bereichen der DNA behebt und zum anderen die sogenannte Transcription Coupled Repair (TCR), welche Schäden an der aktuell zu transkribierenden DNA behebt. Diese beiden Formen unterscheiden sich nur in der Schadenserkennung.
Korrekturlesen durch DNA-Polymerase (Basenfehlpaarungsreparatur)
Bei der Replikation werden die beiden Stränge eines DNA-Doppelstrangs getrennt und jeweils durch Basenpaarung komplementär ergänzt, sodass anschließend zwei (nahezu) identische doppelsträngige DNA-Moleküle vorliegen. Das hieran beteiligte Enzym, eine DNA-abhängige DNA-Polymerase, katalysiert nicht nur die Synthese eines neuen DNA-Strangs aus Nukleotiden anhand der vorliegenden DNA-Matrize. Es kann zudem während des Prozesses eine Fehlpaarung (englisch mismatch) erkennen und rückgängig machen, sodass das korrekt gepaarte Desoxyribonukleotid angefügt werden kann; dies wird als Korrekturlesen (englisch proofreading) bezeichnet.
Diese zusätzliche Funktion der DNA-Polymerase wird mit sehr geringer Fehlerquote ausgeführt, allerdings nicht hundertprozentig genau. Durch die Mithilfe von DNA-Mismatch-Reparaturproteinen wird die Fehlerquote weiter abgesenkt, die Anzahl spontaner Mutationen liegt damit um rund das Tausendfache niedriger. Anhand seines Methylierungsstatus kann hierbei ein womöglich fehlerhaft entstandener Tochterstrang von der Elternstrangmatrize unterschieden werden, da er erst später methyliert wird. Ein Defekt im Ablauf der Mismatchreparatur kann beispielsweise eine Form von Darmkrebs, ein hereditäres non-polypöses kolorektales Karzinom, verursachen.
Photoreaktivierung
Photolyasen sind in der Lage, durch ultraviolette Strahlung in der DNA entstandene Cyclobutan-Ringe und (6-4)-Photoprodukte aufzulösen. Sie verfügen über einen sog. Antennenkomplex, mit dem sie blaues oder ultraviolettes Licht absorbieren und mithilfe dieser Energie vom Kofaktor FAD zwei Elektronen auf den im aktiven Zentrum des Enzyms gebundenen DNA-Schaden übertragen. Selbiger spaltet sich in der Folge. Die Photolyase stellt so ohne Herausschneiden und Einfügen von Basen die native Struktur der DNA wieder her. Bis heute konnten in vielen Organismen von den Prokaryoten über Pilze und Pflanzen bis hin zu Beuteltieren Photolyasen nachgewiesen werden. Trotz ihrer unbestrittenen vorteilhaften Eigenschaften für diese Organismen sind die Photolyasen im Laufe der Evolution mehrfach verloren gegangen.[15] Auch die höheren Säugetiere, zu denen der Mensch zählt, besitzen keine reparaturaktiven Varianten dieser Proteine mehr. Die Gründe hierfür sind bisher nicht abschließend geklärt.
Reparatur von Doppelstrangbrüchen
Die Reparatur eines Doppelstrangbruchs kann generell über homologe Reparaturmechanismen erfolgen oder durch nicht-homologe Reparatur. Nicht-homologe Reparatur ist dabei fehleranfälliger und führt häufiger zu Veränderungen der Ursprungssequenz in Form von Deletionen oder kleineren Insertionen. Diese Eigenschaft macht man sich bei der Genom-Editierung bspw. durch das CRISPR/Cas9-System zunutze um zielgerichtet Mutationen in einem Genom zu erzeugen. Homologe Reparaturmechanismen sind insbesondere in Bakterien und Hefen verbreitet, während in höheren Eukaryoten die meisten Doppelstrangbrüche nicht-homolog repariert werden. Dabei sind homologe Reparaturmechanismen besonders während der S und G2-Zellphase aktiv. Das Schwester-Chromatid ist dann häufig nahe der Bruchstelle und kann als Template zur Reparatur dienen. In der G1 bis frühen S-Phase ist nicht-homologe Reparatur aktiver.
Homologe Reparatur
Homologe Reparatur beginnt mit der Resektion der 5'-Enden eines offenen Bruches durch den MRX-Komplex (MRN in Säugern und Pflanzen) bestehend aus MRE11, Rad50 und XRCC1 (NBS1). U. a. mit Hilfe der Proteine Rad51, Rad54 bindet das einzelsträngige 3'-Ende des Bruchs in einem zur Reparaturstelle homologen Bereich (bspw. dem Schwester-Chromatid) und bildet eine D-Loop genannte Struktur aus. Anhand der homologen Vorlage wird der fehlende Strang synthetisiert. Daraufhin bilden sich zwei Holliday-Strukturen aus, deren Auflösung entweder ein Crossover der beiden Stränge oder eine Auflösung zur Folge hat.
Synthesis dependant strand-annealing (SDSA)
Findet die Bindung des offenen Endes des Doppelstrangbruchs in einem nicht zur Reparaturstelle homologen Bereich statt, spricht man von SDSA. Dies hat zur Folge, dass der Bruch zwar repariert wird, aber sogenannte Filler-Sequenzen eingebaut werden, die aus dem Bereich stammen, an dem sich der D-Loop gebildet hat.
Single strand annealing
Bei Bruch innerhalb zwischen Repeats kann es dazu kommen, dass die Enden des Bruches soweit verkürzt werden, dass homologe Paarung an längeren Bereichen von Homologie erfolgen kann. Der Strang wird nachfolgend repariert, was zu einer Deletion des Bereiches zwischen den beiden Repeats führt.
Nicht-homologe Reparatur
Nicht-homologe Reparatur erfolgt ohne Verwendung einer homologen Vorlage. Zu unterscheiden sind Non-homologous end-joining (NHEJ) und Microhomology-mediated end-joining (MMEJ) – manchmal auch alternative- oder backup-NHEJ genannt.
Non-homologous end-joining (NHEJ)
NHEJ startet durch Bindung des Ku-Komplexes bestehend aus Ku70 und Ku80 an die offenen Enden des Doppelstrangbruchs. Dadurch sind die offenen Enden vor weiterem Abbau durch Exonukleasen geschützt und der Bruch wird stabilisiert. Bei der Bindung der offenen Enden werden oft kurze Bereiche von Homologie zwischen den offenen Enden (sogenannte Mikrohomologie) ausgenutzt. Anschließend erfolgt die Bindung des MRX bzw. MRN-Komplexes (siehe homologe Reparatur), der die offenen Enden prozessiert, sodass sie durch den XRCC4-DNA-LigaseIV-Komplex repariert werden kann. NHEJ wird oft als fehleranfälliger Reparaturmechanismus beschrieben. Die Folge einer Reparatur durch NHEJ sind meistens kleinere Deletionen von wenigen Basen oder kleine Insertionen an der Reparaturstelle.
Microhomology-mediated end-joining (MMEJ)
Bindet der Ku-Komplex nicht an ein offenes Ende, bspw. in Knockout-Mutanten oder während der S oder G2-Phase, wenn Ku70/80 nicht so aktiv ist, findet die Stabilisierung der offenen Enden an längeren Bereichen von Mikrohomologie statt (5-25 bp). Anschließend wird der offene Bruch durch den MRX/MRN-Komplex prozessiert und durch XRCC4/DNA-LigaseIV repariert. Ohne den Schutz durch den Ku-Komplex sind die offenen Enden länger Exonukleasen ausgesetzt. Dadurch und durch die Verwendung von größeren Bereich von Mikrohomologie an der Reparaturstelle können auch größere Deletionen entstehen.
Eine Störung dieser Reparatursysteme manifestiert sich klinisch häufig als Chromosomenbruchsyndrom, wie zum Beispiel das Nijmegen-Breakage-Syndrom.
Reparatur von Quervernetzungen
Quervernetzte DNA führt in Wirbeltierzellen zu einer Aktivierung der Proteine RAD18-SLF1-SLF2, wodurch eine Ubiquitinierung der vernetzten DNA durch RNF8/RNF168 erfolgt und anschließend der SMC5/6-Proteinkomplex bindet.[16]
Transläsionssynthese
Die Transläsionssynthese (TLS) ist ein Prozess zur Tolerierung von DNA-Schäden, der es der DNA-Replikationsmaschinerie ermöglicht, an DNA-Läsionen wie Thymin-Dimeren oder AP-Stellen vorbeizureplizieren. Dabei werden reguläre DNA-Polymerasen gegen spezialisierte Transläsions-Polymerasen ausgetauscht (z. B. DNA-Polymerase IV oder V, aus der Y-Polymerase-Familie), die oft größere aktive Stellen haben, die das Einfügen von Basen gegenüber beschädigten Nukleotiden erleichtern können. Es wird angenommen, dass der Wechsel der Polymerasen unter anderem durch die posttranslationale Modifikation des Replikationsprozessivitätsfaktors PCNA vermittelt wird. Translesions-Synthese-Polymerasen haben oft eine geringe Genauigkeit (hohe Neigung, falsche Basen einzufügen) auf unbeschädigten Vorlagen im Vergleich zu regulären Polymerasen. Viele sind jedoch extrem effizient beim Einfügen korrekter Basen gegenüber spezifischen Schadensarten. Zum Beispiel vermittelt Pol η den fehlerfreien Bypass von Läsionen, die durch UV-Bestrahlung induziert werden, während Pol ι an diesen Stellen Mutationen einführt. Es ist bekannt, dass Pol η das erste Adenin über das T^T-Photodimer mit Watson-Crick-Basenpaarung hinzufügt und das zweite Adenin in seiner syn-Konformation mit Hoogsteen-Basenpaarung hinzugefügt wird.
Aus zellulärer Sicht kann es vorteilhaft sein, das Risiko der Einführung von Punktmutationen während der Translesion-Synthese einzugehen, anstatt auf drastischere Mechanismen der DNA-Reparatur zurückzugreifen, die zu groben Chromosomenaberrationen oder Zelltod führen können. Kurz gesagt, der Prozess beinhaltet spezialisierte Polymerasen, die entweder Läsionen an Stellen gestoppter DNA-Replikation umgehen oder reparieren. Zum Beispiel kann die menschliche DNA-Polymerase eta komplexe DNA-Läsionen wie Guanin-Thymin-Intrastrang-Crosslink, G[8,5-Me]T, umgehen, obwohl sie gezielte und halbgezielte Mutationen verursachen kann. Paromita Raychaudhury und Ashis Basu untersuchten die Toxizität und Mutagenese derselben Läsion in Escherichia coli, indem sie eine G[8,5-Me]T-modifizierte Plasmide in E. coli mit spezifischen DNA-Polymerase-Knockouts replizierten. Die Lebensfähigkeit war sehr gering in einem Stamm, dem Pol II, Pol IV und Pol V fehlten, die drei SOS-induzierbaren DNA-Polymerasen, was darauf hindeutet, dass die Translesion-Synthese hauptsächlich von diesen spezialisierten DNA-Polymerasen durchgeführt wird. Eine Bypass-Plattform wird diesen Polymerasen durch das proliferierende Zellkernantigen (PCNA) bereitgestellt. Unter normalen Umständen repliziert PCNA, das an Polymerasen gebunden ist, die DNA. An einer Läsionsstelle wird PCNA ubiquitiniert oder modifiziert durch die Proteine RAD6/RAD18, um eine Plattform für die spezialisierten Polymerasen zu bieten, um die Läsion zu umgehen und die DNA-Replikation fortzusetzen. Nach der Translesion-Synthese ist eine Verlängerung erforderlich. Diese Verlängerung kann von einer replikativen Polymerase durchgeführt werden, wenn die TLS fehlerfrei ist, wie im Fall von Pol η, doch wenn die TLS zu einer Fehlpaarung führt, ist eine spezialisierte Polymerase erforderlich, um es zu verlängern; Pol ζ. Pol ζ ist einzigartig darin, dass es terminale Missmatches verlängern kann, während prozessivere Polymerasen dies nicht können. Wenn also eine Läsion auftritt, wird die Replikationsgabel stillstehen, PCNA wird von einer prozessiven Polymerase zu einer TLS-Polymerase wie Pol ι wechseln, um die Läsion zu beheben, dann kann PCNA zu Pol ζ wechseln, um das Missmatch zu verlängern, und schließlich wird PCNA zur prozessiven Polymerase wechseln, um die Replikation fortzusetzen.
Literatur
- N. Chatterjee, G. C. Walker: Mechanisms of DNA damage, repair, and mutagenesis. In: Environmental and molecular mutagenesis. Band 58, Nummer 5, Juni 2017, S. 235–263,
doi:
 10.1002/em.22087,
10.1002/em.22087,
 PMID 28485537,
PMID 28485537,
 PMC 5474181 (freier Volltext).
PMC 5474181 (freier Volltext). - Dhara Gohil, Altaf H. Sarker, Rabindra Roy: Base Excision Repair: Mechanisms and Impact in Biology, Disease, and Medicine. In:
International Journal of Molecular Sciences. 2023, Band 24, Nummer 18, S. 14186
doi:
 10.3390/ijms241814186.
10.3390/ijms241814186.
 PMID 37762489.
PMID 37762489.
 PMC 10531636 (freier Volltext).
PMC 10531636 (freier Volltext). - W. A. Beard, J. K. Horton, R. Prasad, S. H. Wilson: Eukaryotic Base Excision Repair: New Approaches Shine Light on Mechanism. In: Annual review of biochemistry.
Band 88, Juni 2019, S. 137–162,
doi:
 10.1146/annurev-biochem-013118-111315,
10.1146/annurev-biochem-013118-111315,
 PMID 31220977,
PMID 31220977,
 PMC 8956022 (freier Volltext).
PMC 8956022 (freier Volltext).
Einzelnachweise
- ↑ C. R. Bartram: Genetische Grundlagen der Kanzerogenese. In: W. Hiddemann, C. R.
Bartram (Hrsg.): Die Onkologie. Teil 1, Ausgabe 2, Verlag Springer, 2009, ISBN 3-540-79724-6, S. 118–127
(
 eingeschränkte Vorschau in der Google-Buchsuche).
eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ S. Uphoff, R. Reyes-Lamothe u. a.: Single-molecule DNA repair in live bacteria.
In: Proceedings of the National Academy of Sciences. Band 110, Nummer 20, Mai 2013, S. 8063–8068,
 doi:10.1073/pnas.1301804110.
doi:10.1073/pnas.1301804110.
 PMID 23630273.
PMID 23630273.
 PMC 3657774 (freier Volltext).
PMC 3657774 (freier Volltext).
- ↑ William J. Broad:
 Nobel Prize in Chemistry
Awarded to Tomas Lindahl, Paul Modrich and Aziz Sancar for DNA Studies In: The New York Times, 7. Oktober 2015
Nobel Prize in Chemistry
Awarded to Tomas Lindahl, Paul Modrich and Aziz Sancar for DNA Studies In: The New York Times, 7. Oktober 2015
- ↑ Staff:
 The Nobel Prize in Chemistry 2015 – DNA repair – providing chemical
stability for life In: Nobel Prize, 7. Oktober 2015
The Nobel Prize in Chemistry 2015 – DNA repair – providing chemical
stability for life In: Nobel Prize, 7. Oktober 2015
- ↑ Rolf Sauer: Strahlentherapie und Onkologie. 5. Auflage, Elsevier GmbH, Urban und Fischer Verlag, München, 2010; ISBN 978-3-437-47501-6, S. 112.
- ↑ Krokan HE, Bjørås M: Base excision repair. In:
Cold Spring Harbor Perspectives in Biology. 5. Jahrgang,
Nr. 4, April 2013,
S. a012583,
doi:
 10.1101/cshperspect.a012583,
10.1101/cshperspect.a012583,
 PMID 23545420,
PMID 23545420,
 PMC 3683898 (freier Volltext).
PMC 3683898 (freier Volltext).
- ↑ del Rivero J, Kohn EC: PARP Inhibitors: The Cornerstone
of DNA Repair-Targeted Therapies. In: Oncology. 31. Jahrgang,
Nr. 4, April 2017,
S. 265–73,
 PMID 28412778.
PMID 28412778.
- ↑ Schärer OD: Nucleotide excision repair in eukaryotes.
In: Cold Spring Harbor Perspectives in Biology. 5. Jahrgang,
Nr. 10, Oktober 2013,
S. a012609,
doi:
 10.1101/cshperspect.a012609,
10.1101/cshperspect.a012609,
 PMID 24086042,
PMC 3783044 (freier Volltext).
PMID 24086042,
PMC 3783044 (freier Volltext).
- ↑ de Boer J, Hoeijmakers JH: Nucleotide excision repair
and human syndromes. In: Carcinogenesis. 21. Jahrgang,
Nr. 3, März 2000,
S. 453–60,
doi:
 10.1093/carcin/21.3.453,
10.1093/carcin/21.3.453,
 PMID 10688865.
PMID 10688865.
- ↑ Satoh MS, Jones CJ, Wood RD, Lindahl T: DNA
excision-repair defect of xeroderma pigmentosum prevents removal of a class of oxygen free radical-induced base lesions. In:
Proceedings of the National Academy of Sciences of the United States of America. 90. Jahrgang,
Nr. 13, Juli 1993,
S. 6335–9,
doi:
 10.1073/pnas.90.13.6335,
10.1073/pnas.90.13.6335,
 PMID 8327515,
PMID 8327515,
 PMC 46923 (freier Volltext),
bibcode:
PMC 46923 (freier Volltext),
bibcode:  1993PNAS...90.6335S.
1993PNAS...90.6335S.
- ↑ Hochspringen nach: a b
c Ceccaldi R, Rondinelli B, D'Andrea AD: Repair Pathway Choices and Consequences at the Double-Strand
Break. In: Trends in Cell Biology. 26. Jahrgang,
Nr. 1, Januar 2016,
S. 52–64,
doi:
 10.1016/j.tcb.2015.07.009,
10.1016/j.tcb.2015.07.009,
 PMID 26437586,
PMID 26437586,
 PMC 4862604 (freier Volltext).
PMC 4862604 (freier Volltext).
- ↑ Kunkel TA, Erie DA: DNA mismatch repair. In:
Annual Review of Biochemistry. 74. Jahrgang, 2005,
S. 681–710,
doi:
 10.1146/annurev.biochem.74.082803.133243,
10.1146/annurev.biochem.74.082803.133243,
 PMID 15952900
(
PMID 15952900
(  zenodo.org).
zenodo.org).
- ↑ Yi C, He C: DNA repair by reversal of DNA damage.
In: Cold Spring Harbor Perspectives in Biology. 5. Jahrgang,
Nr. 1, Januar 2013,
S. a012575,
doi:
 10.1101/cshperspect.a012575,
10.1101/cshperspect.a012575,
 PMID 23284047,
PMID 23284047,
 PMC 3579392 (freier Volltext).
PMC 3579392 (freier Volltext).
- ↑ Lehmann AR:
Replication of damaged DNA by translesion synthesis in human cells. In: FEBS Letters. 579. Jahrgang,
Nr. 4, Februar 2005,
S. 873–6,
doi:
 10.1016/j.febslet.2004.11.029,
10.1016/j.febslet.2004.11.029,
 PMID 15680966.
PMID 15680966.
- ↑ Lucas-Lledó, J.I. & Lynch, M.
 Evolution of mutation rates: phylogenomic analysis of the photolyase/cryptochrome
family. Mol. Biol. Evol 26, 1143–1153 (2009).
Evolution of mutation rates: phylogenomic analysis of the photolyase/cryptochrome
family. Mol. Biol. Evol 26, 1143–1153 (2009).
- ↑ M. Raschle, G. Smeenk, R. K. Hansen, T. Temu, Y. Oka, M. Y.
Hein, N. Nagaraj, D. T. Long, J. C. Walter, K. Hofmann, Z. Storchova, J. Cox, S. Bekker-Jensen, N. Mailand, M. Mann: Proteomics reveals dynamic assembly of repair complexes during
bypass of DNA cross-links. In: Science. 348, 2015, S. 1253671,
 doi:10.1126/science.1253671.
doi:10.1126/science.1253671.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 16.10. 2025