
Plutonium
| Sicherheitshinweise | ||||||
|---|---|---|---|---|---|---|
| ||||||
| weitere Sicherheitshinweise | ||||||
| Radioaktivität | ||||||
 Radioaktives Element | ||||||
Plutonium ist ein chemisches Element mit dem Elementsymbol Pu und der Ordnungszahl 94. Im Periodensystem steht es in der Gruppe der Actinoide (7. Periode, f-Block) und zählt zu den Transuranen. Plutonium ist ein giftiges und radioaktives Schwermetall. Benannt wurde es nach dem Zwergplaneten Pluto. Es gehört zu den schwersten in der Natur vorkommenden Elementen. Dabei wird das Element aber nur in kleinsten Spuren in sehr alten Gesteinen gefunden. Größer ist die Menge, die künstlich in Kernkraftwerken erzeugt wird.

Als eines der wenigen spaltbaren Elemente spielt es eine wichtige Rolle für den Betrieb von Kernkraftwerken und den Bau von Kernwaffen. So war das Spaltmaterial der Atombombe, die am 9.August 1945 auf Nagasaki abgeworfen wurde, Plutonium.
Geschichte
Plutonium wurde von den US-Amerikanern Glenn T. Seaborg, J. W. Kennedy, E. M. McMillan, Michael Cefola und Arthur Wahl entdeckt. Am 14. Dezember 1940 stellten sie das Isotop 238Pu durch Beschuss von Uran 238U mit Deuterium in einem Zyklotron her. Dazu wurden zunächst Proben des Isotops 238U in Form des Oxids U3O8 in dünner Schicht auf einer Kupferplatte aufgetragen. Bei dieser Reaktion werden zwei Neutronen emittiert; das zwischenzeitlich entstehende Neptunium zerfällt zu 238Pu. Den eindeutigen Nachweis für das Element 94 erbrachte A. C. Wahl am 23./24.Februar 1941.
Das zweite Isotop wurde durch Beschuss mit schnellen Neutronen erzeugt:
- Die angegebenen Zeiten sind Halbwertszeiten.
Sie benannten es im März 1942 nach dem damals als äußersten Planeten geltenden Pluto, der wiederum nach dem gleichnamigen römischen Gott der Unterwelt benannt ist: " benannt nach dem jenseits des Neptuns folgenden Planeten Pluto, angesichts der infernalischen Wirkung der Pu-Bombe erscheint die Ableitung des Namens von Pluto, dem Gott der Unterwelt gerechtfertigter!"
Die erste wägbare Menge von etwa 4 μg wurde im August/September 1942 von B. Cunningham, M. Cefola und B. Werner isoliert.
Die Entdeckung wurde während des Zweiten Weltkrieges geheim gehalten. Im Rahmen des US-amerikanischen Manhattan-Projekts wurde Plutonium erstmals in größerem Maßstab hergestellt. Die Atombombe, mit der die japanische Stadt Nagasaki zerstört wurde, enthielt Plutonium 239Pu als Spaltstoff. Joseph Hamilton führte an Versuchspersonen Plutonium-Verteilungsstudien durch, die aufgrund der extremen Giftwirkung des Plutoniums heute umstritten sind.
In Deutschland hatte bereits vor der Entdeckung des Plutonium Carl Friedrich von Weizsäcker darauf hingewiesen, dass in Kernreaktoren ein neues spaltbares Element 239Eka Re (Eka-Rhenium) entstehen müsse. Auch Fritz G. Houtermans sagte 1942 die Existenz von Transuranen in einem Geheimbericht theoretisch voraus. Im Rahmen des deutschen Uranprojekts wurden jedoch bis Kriegsende nach heutigem Kenntnisstand keine signifikanten Mengen an Plutonium hergestellt.
| Eigenschaften | |
|---|---|
| Allgemein | |
| Name, Symbol, Ordnungszahl | Plutonium, Pu, 94 |
| Serie | Actinoide |
| Gruppe, Periode, Block | Gruppe-Ac-Element (Ac), 7, f |
| Aussehen | silbriges Metall |
| CAS-Nummer | 7440-07-5 |
| Massenanteil an der Erdhülle | 2 · 10-16 ppm |
| Physikalisch | |
| Aggregatzustand | fest |
| Modifikationen | 6 |
| Kristallstruktur | monoklin |
| Dichte | 19,816 g/cm3 |
| Magnetismus | paramagnetisch (χm = 6,2 · 10-4) |
| Schmelzpunkt | 912,5 K (639,4 °C) |
| Siedepunkt | 3509 K (3230 °C) |
| Molares Volumen | 12,29 · 10-6 m3/mol |
| Verdampfungswärme | 325 kJ/mol |
| Schmelzwärme | 11,48 kJ/mol |
| Schallgeschwindigkeit | 2260 m/s bei 293,15 K |
| Spezifische Wärmekapazität | 130 J/(kg · K) |
| Elektrische Leitfähigkeit | 6,8 · 105 A/(V · m) |
| Wärmeleitfähigkeit | 6,74 W/(m · K) |
| Chemisch | |
| Oxidationszustände | +3, +4, +5, +6, (+7) |
| Normalpotential | -2,031 V (Pu3+ + 3 e− → Pu) |
| Elektronegativität | 1,28 (Pauling-Skala) |
Natürliches Vorkommen
Plutonium ist mit einem Gehalt von 2 · 10-19 % eines der seltensten Elemente der Erdkruste. In Uranvorkommen kann es in winzigen Mengen durch Neutronenanlagerung (Absorption) natürlich freigesetzter Neutronen aus Uran entstehen. Auf 140 Milliarden Uranatome soll ein Plutoniumatom kommen. Der US-amerikanische Chemiker D. F. Peppard extrahierte im Jahr 1951 Mikrogrammmengen 239Pu aus einem kongolesischen Pechblendekonzentrat. Für jedes Mikrogramm waren 100 Tonnen Pechblende notwendig.
Aus der Entstehungszeit des Sonnensystems wurde im Mineral Bastnäsit, das nach dem Fundort Bastnäs in Schweden benannt wurde, das langlebigste Plutoniumisotop 244Pu gefunden. Mit verfeinerter Spurenanalytik gelang es, geringste Spuren dieses Isotops nachzuweisen. Diese Mengen sind so gering, dass sie erst im Jahr 1971, also nach der künstlichen Erzeugung des Plutoniums in Kernreaktoren, entdeckt wurden. Plutonium kann demnach als natürliches Element gezählt werden, wobei es Uran als letztes bekanntes natürliches Element ablöst. Größere Plutoniummengen entstanden auch im Naturreaktor Oklo.
Vorkommen durch menschlichen Einfluss
Durch oberirdische Kernwaffentests wurden von 1945 bis 1980 etwa 3 bis 5 t freigesetzt, die in Spuren weltweit nachweisbar sind. Weitere Mengen wurden bei Unfällen mit Kernwaffen und in entsprechenden Laboratorien, dem Absturz eines us-amerikanischen Satteliten mit enthaltener Plutoniumdioxid-Batterie (Transit 5BN-3) und von der Wiederaufarbeitungsanlage von Sellafield (KKW Calder Hall Großbritannien) in die Umwelt gebracht.
Der Großteil des bei der Reaktorkatastophe von Tschernobyl entwichenen Plutoniums blieb in einem Umkreis von 100 km um den Reaktor.
Gewinnung und Darstellung
Plutonium entsteht unvermeidlich in den mit 238U-reichen Isotopengemischen betriebenen Kernkraftwerken. Dabei wird das eingesetzte 238U durch Einfang eines Neutrons zu 239Pu umgewandelt.
Ein weiteres Neutron führt in den meisten Fällen zur Kernspaltung, zum Teil entsteht jedoch das Isotop 240Pu. Da dieses Isotop nur schlecht spaltbar ist, führt weiterer Neutroneneinfang zur Entstehung von 241Pu, das wiederum gut spaltbar ist. Allerdings werden nicht alle Atome gespalten, so dass bei einigen davon der Brutprozess zu 242Pu und noch schwereren Isotopen fortgesetzt werden kann. Weil jedoch das spaltbare 243Pu eine sehr kurze Halbwertszeit hat, ist ein weiterer Neutroneneinfang, der meistens zur Spaltung oder — in selteneren Fällen — zur Erzeugung von Plutonium 244Pu führt, unwahrscheinlich. Der Plutonium-Brutprozess ist daher praktisch beim 243Pu zu Ende und führt über den Betazerfall von 243Pu zum Americium-Isotop 243Am.
Da jede Stufe dieser aufeinander aufbauenden Kernreaktionen eine gewisse Zeit braucht, ändern sich im Laufe der Zeit die relativen Mengen der Isotope im Reaktorkern. Die Raten, mit der die Kernreaktionen ablaufen, hängen von der Geschwindigkeitsverteilung der Neutronen ab. Weil ein großer Teil der leicht spaltbaren Isotope jedoch gespalten wird und sich nicht in andere Isotope umwandelt, nimmt die mögliche Ausbeute (Effizienz) des Brutprozesses mit der Erzeugung jedes weiteren leicht spaltbaren Isotops ab.
Das leichtere Isotop 238Pu wird bei Bedarf gezielt hergestellt. Es entsteht durch Einfang mehrerer Neutronen aus dem Uran-Isotop 235U. Dabei entsteht zuerst ein 236U-Kern in einem angeregten Zustand, der eine Halbwertszeit von 120 Nanosekunden hat und sich mit hoher Wahrscheinlichkeit spaltet. Angeregte 236U-Kerne können jedoch auch durch Emission von Gamma-Strahlung in den langlebigen Grundzustand übergehen. Durch weiteren Neutroneneinfang und β-Zerfall entsteht Neptunium 237Np. Nach einer gewissen Bestrahlungszeit wird das Neptunium, das fast ausschließlich aus 237Np besteht, aus den Brennstäben extrahiert. Das Neptunium wird nun in Form von reinen Neptunium-Brennstäben wieder in einen Reaktor eingefügt und mit Neutronen bestrahlt. Es wandelt sich dabei durch Neutroneneinfang in 238Np um, das durch Betastrahlung zu 238Pu zerfällt.
Wird 239Pu durch schnelle, also nicht abgebremste Neutronen gespalten, ist die durchschnittliche Zahl neu freigesetzter Neutronen pro gespaltenem Atomkern besonders hoch. In einem solchen Reaktor kann daher theoretisch mehr 238U in neues 239Pu umgewandelt werden, als gleichzeitig durch Spaltung verbraucht wird. Er wird deshalb als Brutreaktor oder "schneller Brüter" bezeichnet. In der Praxis wurde aber bisher eine maximale Konversionsrate von 0,7 verwirklicht, das Funktionieren einer Brutreaktoren-"Wirtschaft" somit bisher nicht im großen demonstriert.
Die Weitergabe von spaltbarem Material (wie 239Pu und 241Pu) sowie von Materialien, die zu ihrer Herstellung geeignet sind, an Staaten, die keine Kernwaffen besitzen, unterliegt laut Absatz III des Atomwaffensperrvertrages der Kontrolle der IAEO. In Deutschland regelt das Atomgesetz den Umgang mit spaltbarem Material. Es bestimmt, wer unter welchen Bedingungen Plutonium in Deutschland befördern und besitzen darf.
Eigenschaften
Physikalische Eigenschaften
Plutonium ist bei Standardbedingungen ein silberglänzendes Schwermetall mit hoher Dichte (19,86 g/cm3). Wie von allen Actinoiden existieren auch von Plutonium ausschließlich radioaktive Isotope. Es ist selbsterwärmend, pro 100 g Plutonium entstehen etwa 0,2 Watt Wärmeleistung (bezogen auf 239Pu). Plutonium ist im Vergleich mit anderen Metallen ein schlechter Leiter für Wärme und elektrischen Strom. Das Metall kristallisiert abhängig von der Temperatur in insgesamt sechs allotropen Modifikationen. Diese unterscheiden sich zum Teil deutlich in ihren Dichten. Die bei Raumtemperatur stabile Modifikation α-Pu ist monoklin. In Plutonium besteht bei höheren Temperaturen der seltene Fall einer Dichteanomalie, die Dichte nimmt bei der Phasenumwandlung zur δ' und ε-Modifikation wieder zu. Auch beim Schmelzen wird, wie bei Wasser, die Dichte größer. Flüssiges Plutonium besitzt die höchste Viskosität aller bekannten Elemente im flüssigen Zustand. Trotz einer für Metalle anormal hohen magnetischen Suszeptibilität und der Tendenz zur Ordnung bei tiefen Temperaturen zeigt Plutonium keine Ordnung über größere Bereiche und muss deshalb als paramagnetisch bezeichnet werden. Für die Messung stört allerdings das ständige Erwärmen durch den Zerfall des Plutoniums. Dadurch sind keine Temperaturen nahe dem absoluten Nullpunkt erreichbar.
-
Modifikationen bei Atmosphärendruck Phasenbezeichnung stabiler Temperaturbereich Dichte (Temperatur) Kristallsystem Bravais-Gitter Raumgruppe α-Pu 0 K — 395 K 19,77 g/cm3 (293 K) monoklin primitiv 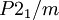
β-Pu 395 K — 479 K 17,7 g/cm3 (395 K) monoklin basiszentriert 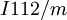
γ-Pu 479 K — 592 K 17,14 g/cm3 (479 K) orthorhombisch flächenzentriert 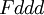
δ-Pu 592 K — 730 K 15,9 g/cm3 (592 K) monoklin basiszentriert 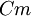
δ'-Pu 730 K — 749 K 16,0 g/cm3 (730 K) tetragonal raumzentriert 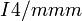
ε-Pu 749 K — 914K 16,5 g/cm3 (749 K) kubisch raumzentriert 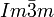
flüssig 914 K — 3503K 16,63g/cm3 (K) — — —
Weiterhin ist eine Hochdruckmodifikation bekannt, die aus α-Pu bei einem Druck oberhalb von 40 GPa gewonnen wurde und in der Raumgruppe P63m kristallisiert.
Chemische Eigenschaften

Plutonium ist ein unedles und sehr reaktives Metall. An der Luft reagiert es schnell mit Sauerstoff und Luftfeuchtigkeit. Dabei wird das Metall zunächst matt und verfärbt sich. Das Metall reagiert beim Erhitzen mit den meisten Nichtmetallen und Wasser. Bei Raumtemperatur wird es dagegen von Wasser und alkalischen Lösungen nicht angegriffen. In konzentrierter Salpetersäure ist es wegen Passivierung nicht löslich. Löslich ist Plutonium in Salzsäure und fluoridhaltiger Salpetersäure. Die Fluoridionen unterdrücken hierbei die ansonsten einsetzende Passivierung des Metalls. Die chemischen Eigenschaften des Plutoniums ähneln denen anderer Actinoiden. Ähnlich wie bei vielen anderen dieser Elemente bestimmt bei Plutonium die starke Radioaktivität die chemischen Eigenschaften mit, da durch die entstehende Wärme Bindungen aufgebrochen werden können. Auch die freiwerdende Strahlung kann zum Bruch von Bindungen führen.
Plutonium besitzt eine Reihe von Verbindungen, in denen es in den Oxidationsstufen +3 bis +7 vorliegen kann. Damit bildet Plutonium zusammen mit Neptunium die höchste Oxidationsstufe aller Actinoiden. Die stabilste Stufe ist +4. In wässriger Lösung haben die Plutoniumionen charakteristische Farben, so ist das Pu3+-Ion violett, Pu4+ braun, PuVO2+ purpurfarben, PuVIO22+ orange und PuVIIO23+ grün.
Biologische Aspekte
Eine biologische Funktion des Plutoniums ist nicht bekannt. Weitere Forschungen und Untersuchungen konzentrierten sich auf mikrobielle Wechselwirkungen mit Plutonium, um auf diesem Wege kontaminierte Deponien und Umgebungen zu sanieren. Enterobakterien der Gattung Citrobacter können durch die Phosphataseaktivität in ihrer Zellwand Pu(IV) aus wässriger Lösung ausfällen und als Lanthan-Phosphat-Komplex binden.
Isotope
Von Plutonium wurden 20 Isotope und 15 Kernisomere mit Massenzahlen von 228 bis 247 vermessen. Die Halbwertszeiten liegen zwischen 37 · 10-12 s für das Isomer 236m1Pu und 80 Mio. Jahren für 244Pu. Die langlebigsten Isotope mit Halbwertszeiten größer als 11 Tagen haben Massenzahlen zwischen 236 und 244. Das Isotop 243Pu ist mit einer Halbwertzeit von weniger als 5 Stunden eine Ausnahme. Einige der Plutonium-Isotope werden als Ausgangspunkte für radioaktive Zerfallsreihen angesehen.
Spaltbarkeit
Plutoniumisotope mit ungerader Neutronenzahl zählen zu den wenigen Nukliden, die durch thermische Neutronen leicht spaltbar sind. Der entsprechende Wirkungsquerschnitt beträgt beim 239Pu 752 Barn (b) und beim 241Pu 1010 b, bei den geradzahligen 238Pu, 240Pu und 242Pu dagegen nur 17 b, 0,4 b bzw. < 0,2 b.
Die meisten langlebigen Plutoniumisotope spalten sich auch spontan. Die Spontanspaltungsrate nimmt bei den schweren Isotopen stark zu.
Die kritische Masse des wichtigsten Isotops 239Pu beträgt (ohne Moderator und/oder Reflektor) 10 kg. Unter diesen Bedingungen haben die anderen Isotope mit ungeraden Neutronenzahlen ebenfalls eine niedrige kritische Masse. Bei dem sehr kurzlebigen 237Pu ist sie mit 3,1 kg besonders niedrig, es wird jedoch wegen seiner kurzen Halbwertszeit, Wärmeproduktion und komplizierten Gewinnung nicht als Spaltstoff für Kernwaffen verwendet. 241Pu hat mit 12,27 — 13,04 kg zwar ebenfalls eine niedrige kritische Masse, die jedoch höher als bei 239Pu ist. Es ist als Spaltstoff für Kernwaffen geeignet und wird deshalb im deutschen Atomgesetz (wie 239Pu) den Kernbrennstoffen zugeordnet. Es wird jedoch, soweit bekannt, wegen seiner kurzen Halbwertszeit und seiner gegenüber 239Pu schwierigeren Produktion, nicht in Kernwaffen verwendet.
Durch schnelle Neutronen sind jedoch auch einige Isotope mit geraden Neutronenzahlen gut spaltbar. Die kritische Masse beträgt (ohne Moderator und/oder Reflektor) bei Plutonium , die kritischen Massen sind bei diesen Isotopen kleiner oder ähnlich hoch wie bei 239Pu. Sie werden jedoch als Spaltstoff für Kernwaffen wegen ihrer kurzen Halbwertszeit, Wärmeproduktion und komplizierten Gewinnung nicht verwendet.
Verwendung
Nur 238Pu und 239Pu werden in größeren Mengen
verwendet. 238Pu ist, wenn es aus Neptunium erbrütet wird, mit
anderen Plutoniumisotopen verunreinigt.
239Pu wird zusammen mit angereichertem Uran zu MOX-Brennelementen (Mischoxyd-Elemente)
verarbeitet. Die MOX-Brennelemente werden in Leichtwasserreaktoren
und mit etwa zehnfach höherer Anreicherung der spaltbaren Isotope in schnellen
Brütern verwendet.

239Pu wird außerdem hochkonzentriert in den meisten Atom- und Wasserstoffbomben als Spaltmaterial verwendet. Weil die Anreicherung des 239Pu gegenüber dem mitproduzierten 240Pu wegen des geringen Gewichtsunterschiedes praktisch nicht möglich ist, wird bei der Produktion von Waffenplutonium der als Ausgangsmaterial dienende Kernbrennstoff nur kurze Zeit der Neutronenstrahlung im Kernreaktor ausgesetzt. Speziell für die Gewinnung von waffenfähigem Plutonium optimierte Reaktoren erlauben daher eine frühzeitige Entnahme der Brennstäbe bei laufendem Betrieb. Trotzdem müssen Atombomben mit Plutonium als Spaltstoff wegen des erhöhten Neutronenhintergrundes durch das Plutonium 240Pu das Implosionsdesign verwenden.
Bei waffenfähigem Plutonium liegt der Anteil des erzeugten 240Pu bei unter 7 %, im Vergleich zum erwünschten Isotop 239Pu. Bei Reaktoren, die zur Stromproduktion betrieben werden, wird der Kernbrennstoff deutlich länger im Reaktor belassen. Der Anteil von 240Pu an diesem als reaktorfähig bezeichneten Plutonium ist größer als 20 %, und 241Pu kommt in diesem Plutonium normalerweise zu etwa 12 % vor.

238Pu erhitzt sich durch seinen eigenen radioaktiven Zerfall bis zur Weißglut, und gibt dabei nur sehr geringe Mengen von Gammastrahlung ab, so dass man mit der dünnsten Abschirmung im Vergleich zu fünf anderen potenziell geeigneten Nukliden auskommt. Es wird deshalb in oxidierter Form als chemisch träges Plutoniumdioxid zur Erzeugung elektrischer Energie in Radionuklidbatterien verwendet. Radionuklidbatterien werden von Raumsonden (z.B. Cassini, New Horizons), die ins äußere Sonnensystem fliegen, eingesetzt, weil Solarzellen in dieser großen Sonnenentfernung nicht genug Energie liefern. Früher wurden Radionuklidbatterien mit Plutonium 238Pu auch in erdumkreisenden Satelliten verwendet.
236Pu-freies 238Pu wurde in den 1970er-Jahren in Herzschrittmachern verwendet, und wurde über den Umweg der wenig ergiebigen und deshalb teuren Erbrütung von Curium 242Cm produziert. Dieses entsteht durch einen Neutroneneinfang von Americium 241Am, das wiederum aus 241Pu gewonnen wird.
Ferner wird 238Pu zusammen mit Beryllium als Neutronenquelle verwendet, wobei ein α-Teilchen aus dem Zerfall des Plutoniums den Berylliumkern trifft und unter Aussendung eines Neutrons in diesen eingebaut wird.
Toxizität
Plutonium ist wie andere Schwermetalle giftig und schädigt besonders die Nieren. Es bindet ebenfalls an Proteine im Blutplasma und lagert sich unter anderem in den Knochen und der Leber ab. Die für einen Menschen tödliche Dosis liegt wahrscheinlich im zweistelligen Milligrammbereich, für Hunde beträgt die LD50-Dosis 0,32 mg/kg Körpergewicht (Letale_Dosis). Die chemische Giftigkeit von Plutonium wird jedoch von vielen anderen Stoffen übertroffen.
Viel gefährlicher als die chemische Wirkung ist seine Radioaktivität, die Krebs verursachen kann. Bereits die Inhalation von 40 Nanogramm 239Pu reicht aus, um den Grenzwert der Jahres-Aktivitätszufuhr für Inhalation bei Arbeitern zu erreichen. Diese Menge ist so winzig, dass die Giftigkeit von Plutonium noch gar nicht zum Tragen kommen kann. Zur sicheren Entstehung von Krebs reicht vermutlich eine Menge von einigen Mikrogramm aus. Die von Plutonium 239Pu ausgesendete α-Strahlung wird außerhalb des Körpers bereits durch die oberste Hautschicht aus abgestorbenen Zellen abgeschirmt. Diesen Schutz gibt es nicht bei Inkorporation, beispielsweise Inhalation von Plutonium enthaltendem Staub, oder durch verunreinigte Nahrung. In diesen Fällen kann die mit dem umgebenden Material stark wechselwirkende α-Strahlung unmittelbar die Zellkerne lebender Zellen treffen.
Nach Untersuchungen des Forschers Arnulf Seidel vom Institut für Strahlenbiologie des Kernforschungszentrum Karlsruhe führen kleine Dosen 239Pu im Langzeitversuch erst nach frühestens zehn Jahren bei Hunden zu Knochenkrebs, wobei es eine fünf mal größere Gefährlichkeit als Radium zeigt. Der Grund dafür kann eine ungleichmäßige Verteilung des Plutoniums im Skelett sein, die zu punktuell stark bestrahlten Stellen führt.
Das wie auch 240Pu in Kernreaktoren immer miterbrütete 241Pu zerfällt zum größten Teil in Americium 241Am, das große Mengen relativ weicher Gammastrahlung abgibt. Die Konzentration von 241Am erreicht nach 70 Jahren ihren Höchststand. Weil die Plutoniumisotope selbst kaum Gammastrahlung abgeben, nimmt diese Strahlung (und damit die Dicke der benötigten Abschirmung) wegen des gebildeten Americiums zunächst deutlich zu, um dann nach etwa 70 Jahren Lagerung wieder abzunehmen. Wegen der längeren Halbwertzeit von 241Am erfolgt diese Abnahme deutlich langsamer als der Anstieg.
Sicherheitshinweise
Einstufungen nach der Gefahrstoffverordnung liegen nicht vor, obwohl die chemische Giftigkeit bekannt ist. Beim Umgang mit Plutonium ist vor allem wegen seiner starken Radioaktivität äußerste Vorsicht geboten. Da die α-Strahlung des Plutoniums nur auf kurze Reichweiten wirkt, ist besonders darauf zu achten, dass das Metall nicht in den Körper gelangt. Da während des Zerfalls Wärme entsteht, muss diese abgeführt werden. Dazu bewahrt man Plutonium am besten unter trockener, zirkulierender Luft auf. Feinverteiltes Plutonium ist pyrophor.
Weiterhin muss unbedingt verhindert werden, dass eine kritische Masse entsteht, die zur nuklearen Kettenreaktion und damit zu unkontrollierter Energie- und Strahlungsfreisetzung führt. Die Unterkritikalität kann entweder durch ausreichend kleine Massen oder eine sichere Geometrie erreicht werden. Bei dieser ist die Oberfläche groß genug, so dass mehr Neutronen verloren gehen als bei neutroneninduzierten Spaltungen entstehen. Eine weitere Möglichkeit ist der Einsatz neutronenabsorbierender Materialien wie Bor, die diese vor möglichen neuen Spaltungsreaktionen abfangen. Grundsätzlich ist zu beachten, dass die kritische Masse durch die Anwesenheit bestimmter Stoffe, insbesondere Wasser, aufgrund deren neutronenmoderierender oder -reflektierender Wirkung auch stark gesenkt werden kann.
Verbindungen
Oxide
Die stabilste und wichtigste Sauerstoffverbindung ist Plutoniumdioxid (PuO2). Diese Verbindung ist ein Feststoff mit hoher Schmelztemperatur. Es ist gegenüber Wasser stabil und nicht in diesem löslich. Plutonium wird daher in Radionuklidbatterien und Kernkraftwerken in Form dieses Oxids verwendet. Neben Plutoniumdioxid sind auch Plutonium(III)-oxid Pu2O3 und Plutonium(II)-oxid PuO bekannt.
Halogenide
Mit den Halogenen Fluor, Chlor, Brom und Iod bildet Plutonium zahlreiche Verbindungen. Von allen Halogenen ist eine entsprechende Plutoniumverbindung in der Oxidationsstufe +3 bekannt. Daneben existieren noch Plutonium(IV)-fluorid, Plutonium(IV)-chlorid und Plutonium(VI)-fluorid.
| Oxidationszahl | F | Cl | Br | I |
| +6 | Plutonium(VI)-fluorid PuF6 rotbraun |
|||
| +4 | Plutonium(IV)-fluorid PuF4 rotbraun |
Plutonium(IV)-chlorid PuCl4 |
||
| +3 | Plutonium(III)-fluorid PuF3 violett |
Plutonium(III)-chlorid PuCl3 grün |
Plutonium(III)-bromid PuBr3 grün |
Plutonium(III)-iodid PuI3 grün |
Es gibt vier bekannte Bor Verbindungen. Sie werden genutzt, um die Radioaktivität von Plutonium zu vermindern.
Analytik
Für Plutonium gibt es aufgrund seiner Seltenheit keine klassischen, nasschemischen Nachweismethoden. Deshalb werden nur instrumentelle Verfahren eingesetzt.
Plutonium wird häufig über die α-Strahlung der Isotope 239(40)Pu und 238Pu nachgewiesen. Eine direkte Analyse ist oft nicht möglich, sodass vorangehende Separationstechniken durchgeführt werden müssen. Häufig kommt dabei die Ionenaustauschchromatographie zum Einsatz. Mit Hilfe der α-Spektrometrie konnte 239(40)Pu in maritimen Sedimenten mit einer Nachweisgrenze von 1 mBq/g bestimmt werden.
Für die Plutoniumbestimmung kommen in der Massenspektrometrie die ICP-Ionisierung (ICP, induktiv-gekoppeltes Plasma, Massenspektrometrie mit induktiv gekoppeltem Plasma) und die AMS (Beschleuniger-Massenspektrometrie) zum Einsatz. Im Vergleich zur ICP-MS ist die AMS sensitiver aber apparativ aufwändig und kostenintensiv, da ein Teilchenbeschleuniger zur Ionisierung verwendet werden muss. Mit der AMS konnte am VERA-System in Wien eine Nachweisgrenze von etwa 106 Atomen des Isotops 239Pu erreicht werden. Mit Hilfe der ICP-Technik konnte eine Nachweisgrenze von 108 Atomen 239Pu erzielt werden, was einer Aktivität von 0,1 mBq entspricht.
Plutonium kann auch mit einer laserbasierten Variante der Atomspektroskopie nachgewiesen werden. Bei der LIBS-Technik (laser-induced breakdown spectroscopy) nutzt man kurze Laserimpulse zur Verdampfung und Emissionsstimulation der Probe. Zur Emissionsmessung steht ein breites Spektrum an Linien zur Verfügung, wobei aufgrund der besten Intensitätswerte meist auf die Linien bei 295,16 nm, 300,06 nm und 363,22 nm zurückgegriffen wird. Mit dieser Technik konnte eine Nachweisgrenze von 10-8 g/mol erzielt werden. Die gleiche Nachweisgrenze konnte mit der ICP-OES (induktiv-gekoppeltes Plasma) erzielt werden.
Ber der Laserinduzierte photoakustische Spektrometrie (LIPAS) wird ein hochenergetischer Laserimpuls in die Probelösung geschickt, welcher eine photoakustische Welle induziert. Mit Hilfe eines piezoelektrischen Detektors wird die Amplitude dieser Welle bestimmt. Mit dieser Technik konnte sechswertiges Plutonium mit einer Nachweisgrenze von 0,5 μg/mL nachgewiesen werden.
Plutoniuminventar
Das weltweite Inventar an Plutonium ist zum Stand des Jahres 1999 gegeben. Die Angaben beruhen auf Schätzungen des Department of Energy. Die Zahlen in Klammern geben den aus dem abgebrannten Brennstoff extrahierten Plutoniumanteil an. Waffenfähiges Plutonium (weapon grade) enthält weniger als 7 % des Isotopes 240Pu. Plutonium kommerzieller Qualität (commercial grade) setzt sich aus Brennstoffplutonium (fuel grade) mit 7 bis 18 % 240Pu und Reaktorplutonium (reactor grade) mit mehr als 19 % 240Pu zusammen.
-
Staat waffenfähig (in t) kommerzielle Qualität (in t) Argentinien 0 6 Belgien 0 23 — 31 Brasilien 0 0,6 Großbritannien 7,6 98,4 (51) Volksrepublik China 1,7 — 2,8 1,2 Frankreich 6 — 7 151 — 205 (70) Deutschland 0 75 — 105 (17) Indien 0,15 — 0,25 6 Israel 0,3-0,5 0 Japan 0 119 — 262 (21) Kasachstan 2 — 3* 0 Nordkorea 0,025 — 0,035 0 Russland 140 — 162 65 (30) USA 85 257,2 (14,5) Gesamt 242,3 — 267,4 802,4 — 1037,4 (~203,5)

Basierend auf einem Artikel in Wikipedia.de
 Atomwaffensperrvertrag
Atomwaffensperrvertrag  im Bestand der IEAO (engl.)
im Bestand der IEAO (engl.) Deutsche Übersetzung des Atomwaffensperrvertrags
Deutsche Übersetzung des Atomwaffensperrvertrags  vom Bundesministerium der Äußeren
vom Bundesministerium der Äußeren Gesetz über die friedliche Verwendung der Kernenergie und den
Schutz gegen ihre Gefahren (Atomgesetz).
Gesetz über die friedliche Verwendung der Kernenergie und den
Schutz gegen ihre Gefahren (Atomgesetz).

© biancahoegel.de
Datum der letzten Änderung: Jena, den: 05.01. 2024
![\mathrm{^{238}_{\ 92}U\ +\ ^{2}_{1}D\ \longrightarrow \ ^{238}_{\ 93}Np\ +\ 2\ ^{1}_{0}n \quad;\quad ^{238}_{\ 93}Np\ \xrightarrow[2,117 \ d]{\beta^-} \ ^{238}_{\ 94}Pu}](/png/53c45b33d6ce89c6d2848b01254fc82b.png)
![\mathrm{^{238}_{\ 92}U\ +\ ^{1}_{0}n\ \longrightarrow \ ^{239}_{\ 92}U\ \xrightarrow[23,5 \ min]{\beta^-} \ ^{239}_{\ 93}Np\ \xrightarrow[2,3565 \ d]{\beta^-} \ ^{239}_{\ 94}Pu}](/png/192cd297784d8278559068adba95c532.png)