Chemisches Element
Chemisches Element ist die Sammelbezeichnung für alle Atomarten mit derselben Anzahl an Protonen im Atomkern. Somit haben alle Atome eines chemischen Elements die selbe Kernladungszahl (auch Ordnungszahl). Die Elemente werden im Periodensystem der Elemente nach steigender Kernladungszahl angeordnet.
Von den über 100 bekannten Elementen sind 80 stabil. Alle stabilen Elemente kommen auf der Erde vor. Nur 17 dieser Elemente bilden keine Metalle. Einige davon verbinden sich mit Atomen des gleichen Elements (Protonenzahl) zu Molekülen. Dazu zählen alle unter Standardbedingungen gasförmigen Elemente, die nicht Edelgase sind: Wasserstoff (H2), Stickstoff (N2), Sauerstoff (O2), Fluor (F2) und Chlor (Cl2). Edelgase reagieren nicht mit sich selbst und bestehen deshalb aus einzelnen Atomen.
Geschichtliches
In der Antike und bis weit ins Mittelalter hatte die Meinung von Aristoleles bestand, dass die Welt aus den vier Elementen Erde, Wasser, Luft und Feuer aufgebaut ist.
Von den Elementen im heutigen Sinne waren in der Antike nur wenige in Reinform bekannt, die entweder gediegen vorkamen oder aus Erz geschmolzen werden konnten:
Kohlenstoff, Schwefel, Eisen, Kupfer, Zink,
Silber, Zinn, Gold,
Quecksilber und Blei.
Im Laufe der mittelalterlichen Bergbaugeschichte Europas wurden dann, vor allem im Erzgebirge, in Erzen geringe Mengen an Beimengungen unbekannter Metalle entdeckt
und nach Berggeistern benannt (Cobalt, Nickel, Wolfram).
Die Entdeckung des Phosphors 1669 durch
Hennig Brand läutete schließlich das Zeitalter der Entdeckung der meisten Elemente ein, einschließlich
des Urans aus Pechblende durch
Martin Heinrich Klaproth 1789. Im Laufe des 19. Jahrhundert wurden die Metalle der Seltenen Erden entdeckt, womit fast alle natürlich vorkommenden Elemente bekannt
waren.
In dieser Zeit wurden auch viele hypothetische Elemente postuliert, die später wieder verworfen wurden. Im 20. und dem
begonnenen 21. Jahrhundert wurden viele in der Natur nicht vorkommende
Elemente - die Transurane - künstlich erzeugt, teils in Kernreaktoren, teils in Teilchenbeschleunigern.
Allen diesen Elementen ist gemeinsam, dass sie instabil sind, d. h.
dass sie sich unterschiedlich schnell in andere Elemente umwandeln. Mit
der Entdeckung weiterer solcher kurzlebiger Elemente ist zu rechnen,
sie entstehen jeweils in nur äußerst geringen Mengen.
Robert Boyle definierte 1661 ein chemisches Element als einen Reinstoff, der mit chemischen Methoden nicht weiter zerlegt werden kann (Boyle, The Sceptical Chymist) und verwendete somit den Begriff ganz anders als zuvor die Vier-Elemente-Lehre (Feuer, Wasser, Luft und Erde).
Der heutige Element-Begriff nimmt für die Stoffe eine Einteilung nach ihren Bestandteilen, den Atomen, vor. Er geht auf John Dalton und seine Atomhypothese zurück, ist abstrakter, dafür aber auch präziser. Seine praktische Bedeutung liegt darin, dass er Atome mit gleichem chemischen Verhalten bei chemischen Reaktionen zusammenfasst. Das sind Atome mit gleicher Protonenzahl. Die Stoffumwandlungen (auch als chemische Reaktion bezeichnet) der chemischen Elemente sind Gegenstand der Chemie.
Atome desselben Elements (gleicher Protonenzahl) können sich in der Anzahl der enthaltenen Neutronen und somit in der Masse unterscheiden (Isotope) und bei nuklearen Reaktionen unterschiedlich verhalten. Die Entstehung der einzelnen Atomsorten (Nuklide) durch Kernreaktionen, die zumeist im Inneren der Fixsterne ablaufen, Umwandlungen sind Gegenstand der Physik.
Eigenschaften
Alle Atome eines Elements haben im elektrisch ungeladenen Zustand die der Protonenzahl entsprechende gleiche Anzahl Elektronen in der Elektronenhülle. Die chemischen Elemente zählen wie die Verbindungen zu den Reinstoffen. Reinstoffe sind physikalisch nicht weiter trennbar und stehen somit im Gegensatz zu den Stoffgemischen. Elemente treten im Universum mit einer bestimmten Elementhäufigkeit auf.
Reinelemente
Ein Reinelement, auch anisotopes Element, ist ein chemisches Element, von dem auf der Erde (vor dem Eingriff des Menschen) nur ein einziges stabiles oder langlebiges Isotop existiert. In einem natürlichen Vorkommen eines Reinelements haben alle seine Atome dieselbe Atommasse und stimmen auch in allen übrigen Eigenschaften überein. Alle anderen Elemente nennt man Mischelemente.
Es existieren 22 Reinelemente, von denen drei (Bismut, Thorium und Plutonium) instabil sind:
Beryllium, Fluor, Natrium, Aluminium, Phosphor, Scandium, Mangan, Cobalt, Arsen, Yttrium, Niob, Rhodium, Iod, Caesium, Praseodym, Terbium, Holmium, Thulium, Gold, Bismut, Thorium und Plutonium.
Bismut, Thorium und Plutonium sind zwar nicht stabil, es existieren aber aufgrund ihrer sehr großen Halbwertszeit noch natürliche Vorkommen, so dass auch sie zu den Reinelementen gezählt werden müssen.
Alle Reinelemente außer Beryllium, Thorium und Plutonium besitzen ungerade Ordnungszahlen. Der Umstand, dass auch die Massenzahlen der meisten Reinelemente ungerade sind, mündete in die Mattauchsche Isobarenregel.
Mischelemente
Ein Mischelement ist ein chemisches Element, von dem in der Natur mehrere Isotope existieren. Es besteht also aus mehreren unterschiedlichen Atomsorten, die alle die gleiche Anzahl Protonen, aber eine unterschiedliche Anzahl Neutronen im Atomkern enthalten.
Die meisten der natürlich vorkommenden Elemente (siehe Nuklidkarte) sind Mischelemente. Davon hat Zinn (Sn) mit 10 stabilen Isotopen die höchste Anzahl natürlich vorkommender Isotope. Nur 22 Elemente sind Reinelemente. Von diesen sind auch nur 19 absolut stabil; Thorium, Plutonium und Bismut sind dagegen radioaktiv, allerdings mit sehr langen Halbwertszeiten.
Auch bei einigen Mischelementen gibt es natürliche radioaktive Isotope, deren Halbwertszeit oft Millionen Jahre beträgt. Somit sind viele Mischelemente grundsätzlich – wenn auch leicht – radioaktiv. Durch den radioaktiven Zerfall ändert sich das Isotopen-Verhältnis von beispielsweise Kalium in seinen Verbindungen mit der Zeit. Dies kann zur Altersbestimmung von Fossilien benutzt werden. Von Bedeutung ist ebenfalls die Radiokohlenstoffmethode.
Chemische Verbindungen
Chemische Elemente können, bis auf einige Edelgase, chemische Verbindungen eingehen. Dabei sind mehrere der elementaren Atome zu Molekülen oder Ionenkristallen zusammengeschlossen.
Natürliche oder künstliche Reinstoffe sind entweder Elemente oder Verbindungen.
Elemente können eine Verbindung mit anderen Elementen oder auch mit sich selbst eingehen: Bei vielen Gasen wie Chlor Cl oder Fluor F verbinden sich zwei Atome desselben Elements untereinander zu einem Molekül, also Cl2 bzw. F2. Gewöhnliches Wasser (Summenformel: H2O) ist hingegen eine Verbindung aus den Elementen Wasserstoff H (2 Atome pro Molekül) und Sauerstoff (1 Atom pro Molekül).
Unlegierte Metalle wie Eisen Fe oder Kupfer Cu sind dagegen stets Elemente.
Grundsätzlich gibt es vier Arten von chemischen Verbindungen zwischen den Atomen der Elemente:
- Molekulare Verbindungen entstehen aus Nichtmetall und Nichtmetall - sie sind Nichtleiter (elektrisch nicht leitfähig) mit zumeist relativ niedrigem Siedepunkt (Diamantartige oder Kunststoffartige Verbindungen mit Riesenmolekülen ausgenommen). Beispiele für molekulare Verbindungen sind neben Wasser auch Methangas, Zucker) usw.
- Ionische Verbindungen entstehen aus Metall(kation) und Nichtmetall(anion). Sie sind salzartige: spröde, von hohem Schmelzpunkt und elektrisch leitfähig nur in Schmelze oder Lösung. Beispiele für Ionenverbindungen sind Eisen-II-oxid (dem Rost ähnlich) und Kochsalz (Natriumchlorid).
- Metallische Verbindungen entstehen aus Metall und Metall - sie sind elektrisch leitfähig, gut verformbar, glänzend und gute Wärmeleiter. Beispiele für derlei Legierungen sind Bronze und Messing).
- Verbindungen höherer Ordnung (Komplexe) entstehen bei einer Komplexbildungsreaktion zumeist aus Buntmetallkation und Molekülen mit freien Elektronenpaaren (Liganden). Sie sind oft auffallend farbig; Beispiele: Der rote Blutfarbstoff Hämoglobin aus Eisen-II-ionen und Eiweißmolekülen und der tiefblaue Kupfertetrammin-Komplex aus Kupfer-II-ionen und Ammoniak).
Die Entstehung von Elementen
|
|
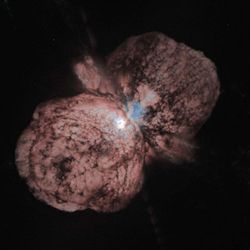
Gegen Ende ihrer Leuchtphase erzeugen schwere Sterne auch schwerere Atomkerne und stoßen das Material nach der
Explosion als Super Nova in Form von Wolken aus. Hier: Nebel um den extrem massereichen 'eta Carinae', entstanden durch Eruptionen vor 100 bis 150 Jahren. |
Bereits beim Urknall entstanden die leichten Elemente Wasserstoff (ca. 75%) und Helium (ca. 25%), zusammen mit geringen Mengen Lithium und Beryllium.
Schwerere Elemente entstehen im Universum durch Kernreaktionen in den Sternen (meist durch Kernfusion). Am Anfang der Kosmochemie steht daher der Wasserstoff mit einer relativen Atommasse von ca. 1,0 u (ein Proton). In Hauptreihen-Sternen, wie unserer Sonne, verschmelzen unter hoher Temperatur (mehrere Millionen Grad Celsius) und hohem Druck z.B. vier Wasserstoffatomkerne über mehrere Zwischenstufen zu einem Heliumatomkern (relative Atommasse ca. 4,0 u). Dieser ist ein wenig leichter als die vier Protonen zusammen, die Massendifferenz wird als Energie frei.
Die Fusion geht auf diese Art (Atome mit geringerer Protonenzahl und relativer Atommasse verschmelzen zu höheren unter Abgabe von Energie) in den meisten Sternen bis zum Kohlenstoff, in massereichen bis zum Eisen weiter. Die Energieausbeute wird dabei immer geringer. Eisen ist der am dichtesten gepackte Atomkern, bei Fusionsreaktionen darüber hinaus wird Energie verbraucht anstatt freigesetzt.
Schwerere Elemente als Eisen entstehen in Sternen am Ende ihrer Lebensdauer. Dabei fangen Atomkerne Neutronen ein und werden so in Elemente höherer Ordnungszahl umgewandelt. Dies geschieht im sogenannten s-Prozess (bei massearmen Sternen) oder im r-Prozess (bei massereichen Sternen während einer Supernova).
Ein Stern verliert am Ende seiner Lebensdauer große Mengen Material (kontinuierlich durch Sonnenwind oder explosiv in einer Supernova), dadurch gelangen die entstandenen Elemente zurück in das interstellare Medium. Jüngere Sternensysteme enthalten daher bereits von Anfang an auch geringe Mengen schwererer Elemente, die z.B. Planeten wie in unserem Sonnensystem bilden können.
Häufigkeit
Die Häufigkeit von chemischen Elementen unterscheidet sich je nach Bereich, den man betrachtet.
Im Universum ist sie eng verknüpft mit den Entstehungsprozessen im kosmologischen Zeitrahmen.
Alle anderen Elemente bis einschließlich Eisen entstanden durch Kernfusion
in Sternen oder andere astrophysikalische Vorgänge.
Die Verteilung auf der Erde unterscheidet sich von derjenigen, die im gesamten Universum vorherrscht. Insbesondere sind auf der Erde im Vergleich geringe Mengen Wasserstoff und Helium vorhanden. Dies beruht darauf, dass diese Gase sich im Sonnensystem vor allem in den Gasplaneten wie Jupiter und Neptun befinden. Auf den Gesteinsplaneten wie der Erde überwiegen die schwereren Elemente, vor allem Sauerstoff, Silicium, Aluminium und Eisen.

© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 28.01. 2020