
Lösungsmittel
Ein Lösungsmittel (auch Lösemittel oder Solvens) ist ein Stoff, der Gase, Flüssigkeiten oder Feststoffe lösen oder verdünnen kann, ohne dass es dabei zu chemischen Reaktionen zwischen gelöstem Stoff und lösendem Stoff kommt. In der Regel werden Flüssigkeiten wie Wasser und flüssige organische Stoffe zum Lösen anderer Stoffe eingesetzt. Aber auch Feststoffe können andere Stoffe lösen. Beispielsweise wird in Wasserstofftanks Brennstoffzell-betriebener Autos gasförmiger Wasserstoff in festem Material (Metall-organische Gerüstverbindungen, kurz MOFs) gelöst.
Lösungsmittel oder Lösemittel
Beide Bezeichnungen finden sich seit über 200 Jahren in der Literatur. Im Forschungs- und Laborbereich hat sich Lösungsmittel etabliert, in der industriellen und technischen Großchemie dagegen Lösemittel. Beispielsweise spricht das Römpp Lexikon Chemie von Lösungsmittel, während die TRGS Lösemittel bevorzugen.
Definition im Alltag
Das meistverwendete Lösungsmittel ist Wasser. Im Hinblick auf Farben, Lacke, Klebstoffe usw. denkt man jedoch bei dem Begriff „Lösungsmittel“ an Stoffe, die unangenehme Gerüche, Gesundheits- und Umweltschäden sowie explosive Dämpfe verursachen können. Gemeint sind hierbei Lösemittel im Sinne der TRGS (Technische Regeln für Gefahrstoffe) 610, nach der nur flüchtige organische Lösemittel mit einem Siedepunkt bis 200 °C als Lösemittel bezeichnet werden.
Die „Hochsieder“, wenig flüchtige Substanzen mit Siedepunkten über 200 °C, gelten daher rechtlich nicht als Lösemittel. Während klassische Lösemittel aufgrund ihrer Flüchtigkeit schon wenige Stunden bis Tage nach der Verarbeitung vollständig verdunstet sind, können die in manchen „lösemittelfreien“ Produkten ersatzweise enthaltenen Hochsieder unter Umständen noch über Monate oder Jahre an die Raumluft abgegeben werden und werden daher teils sogar deutlich kritischer beurteilt als Produkte mit klassischen Lösemitteln.
Die Vermeidung von giftigen und umweltschädlichen Substanzen ist Bestandteil der Grünen Chemie.
Chemie
Obwohl das Lösungsmittel nicht selbst an der chemischen Reaktion teilnimmt, ist es für chemische Reaktionen sehr wichtig. Die Wirkungen des Lösungsmittels sind unterschiedlich und hängen von der Reaktion ab. Durch die Lösung von Reaktionspartnern in einem Lösungsmittel werden Reaktionen thermisch kontrollierbar. Konzentrationsangaben von Stoffen, die in einem Lösungsmittel gelöst sind, gelten wegen Temperaturabhängigkeit nur für eine bestimmte Temperatur.
Die wichtigsten Aufgaben des Lösemittels bei chemischen Reaktionen sind
- konvektiver Wärme- und Stofftransport
- Stabilisierung von Übergangszuständen der Reaktion
- Verdünnung zur Vermeidung von Nebenreaktionen
Für die Reinigung und Prozessierung von Reaktionsgemischen (Downstream-Prozess) spielen Lösungsmittel eine weitere wichtige Rolle. Hier seien exemplarisch einige wichtige Verfahrensweisen benannt:
Marktwirtschaftliche Aspekte
Die wichtigste Lösungsmittel-Gruppe sind Alkohole, wie Ethanol, n-Butanol, Isopropanol und Methanol. Im Jahr 2011 wurden hiervon weltweit ca. 6,4 Mio. Tonnen nachgefragt. Ein überdurchschnittlicher Verbrauchsanstieg von jährlich mehr als 3 % wird in der Periode 2011 bis 2019 bei Ethanol sowie bei den Ethern erwartet. Neben den halogenierten Lösungsmitteln, die in Westeuropa und Nordamerika ihren Abwärtstrend fortsetzen, werden auch Aromaten und reine Kohlenwasserstoffe langfristig weiter an Bedeutung verlieren.
Löseeigenschaften
Die quantitative Vorhersage von Löseeigenschaften ist schwierig und entzieht sich oft der Intuition. Es lassen sich generelle Regeln aufstellen, die jedoch nur als grobe Richtschnur gelten können.
Polare Stoffe lösen sich im Allgemeinen gut in polaren Lösemitteln (z.B. Salze in Wasser). Unpolare Stoffe lösen sich im Allgemeinen gut in unpolaren Lösemitteln (z.B. unpolare organische Stoffe in Benzol oder Ether).
Lösungsmittel werden meist nach ihren physikalischen Eigenschaften in Klassen eingeteilt. Solche Einteilungskriterien sind z.B.:
- Siedepunkt
- Permittivität
- Flammpunkt
- Flüchtigkeit
- Viskosität
- Polarität
- CH-Acidität
Aprotische Lösungsmittel
Verfügt ein Molekül nicht über eine funktionelle Gruppe, aus der Wasserstoffatome im Molekül als Protonen abgespalten werden können (Dissoziation), spricht man von einem aprotischen Lösungsmittel. Diese stehen den protischen Lösungsmitteln gegenüber.
aprotisch-unpolar
Alkane sind wegen des geringen Unterschieds in der Elektronegativität zwischen Kohlenstoff und Wasserstoff unpolar. Dies macht alle Stoffe dieser Gruppen ineinander leicht löslich; sie sind sehr lipophil (eigentlich noch lipophiler als die sehr schwach polaren, namensgebenden Fette) und sehr hydrophob (wasserabweisend). Aber nicht nur Wasser kann sich nicht lösen, sondern alle anderen stark polaren Stoffe auch nicht, wie z.B. kurzkettige Alkohole, Chlorwasserstoff oder Salze. In der Flüssigkeit werden die Teilchen lediglich von Van-der-Waals-Kräften zusammengehalten. Deshalb fallen bei dieser Stoffgruppe die Siedetemperaturen im Vergleich zu Molekülgröße und -masse wesentlich niedriger aus als bei permanenten Dipolen. Da eine Abspaltung von Protonen unter Bildung von Carbanionen nur mit extrem starken Basen möglich ist, sind sie aprotisch. Ebenfalls zur Gruppe der aprotisch-unpolaren Lösungsmittel gezählt werden außerdem Verbindungen wie etwa Carbonsäureester oder Ether, die zwar polare Bindungen enthalten, aufgrund ihrer niedrigen Permittivität jedoch nicht in der Lage sind, ionische Verbindungen aufzulösen.
Vertreter dieser Gruppe sind:
- Alkane (Paraffine)
- Alkene (Olefine), Alkine
- Benzol und andere Aromaten mit aliphatischen und aromatischen Substituenten
- Carbonsäureester
- Ether, z.B. Diethylether
- völlig symmetrisch gebaute Moleküle wie etwa Tetramethylsilan oder Tetrachlorkohlenstoff
- Kohlenstoffdisulfid, bei hohem Druck auch Kohlenstoffdioxid
- halogenierte Kohlenwasserstoffe, die entweder (wie Tetrachlorkohlenstoff) völlig unpolar oder aber trotz der hohen Elektronegativität des betreffenden Halogens, z.B. Chlors, nur wenig polar (Methylenchlorid) sind
-
- Eine spezielle Untergruppe halogenierter Kohlenwasserstoffe bilden dabei die perfluorierten Kohlenwasserstoffe (z.B. Hexafluorbenzol), die nicht nur selber unpolar, sondern auch sehr schlecht von außen polarisierbar sind und sich daher auch mit den übrigen unpolaren Lösungsmitteln eher schlecht vertragen.
aprotisch-polar
Ist das Molekül jedoch mit stark polaren funktionellen Gruppen wie der Carbonylgruppe, der Nitrogruppe oder der Nitrilgruppe substituiert, so weist das Molekül ein Dipolmoment auf, zwischenmolekular tritt nun also elektrostatische Anziehung dauerhafter Dipole zu den immer noch vorhandenen (aber viel schwächeren) Van-der-Waals-Kräften hinzu. Dies hat eine wesentliche Erhöhung des Siedepunktes zur Folge und in vielen Fällen eine Verschlechterung der Mischbarkeit mit unpolaren Lösungsmitteln sowie eine Verbesserung der Löslichkeit von und in polaren Stoffen. Typische aprotisch-polare Lösungsmittel weisen eine Permittivität über 15 auf und sind in der Lage, Kationen zu solvatisieren. Da die Anionen kaum solvatisiert werden (nackte Anionen), zeigen sie eine hohe SN2-Reaktivität. Derartige Lösungsmittel sind hervorragend geeignet, um nukleophile Substitutionen unter milden Bedingungen durchzuführen. Dazu gehören:
- Ketone, z.B. Aceton
- Lactone wie γ-Butyrolacton
- Lactame wie N-Methyl-2-pyrrolidon
- Nitrile wie Acetonitril
- Nitroverbindungen wie Nitromethan
- tertiäre Carbonsäureamide wie Dimethylformamid
- Harnstoffderivate wie Tetramethylharnstoff oder Dimethylpropylenharnstoff (DMPU)
- Sulfoxide wie Dimethylsulfoxid (DMSO)
- Sulfone wie Sulfolan
- Kohlensäureester wie Dimethylcarbonat oder Ethylencarbonat
Protische Lösungsmittel
Sobald ein Molekül über eine funktionelle Gruppe verfügt, aus der Wasserstoffatome im Molekül als Protonen abgespalten werden können (Dissoziation), spricht man von einem protischen Lösungsmittel. Diese stehen den aprotischen Lösungsmitteln gegenüber.
Das wichtigste protische Lösungsmittel ist Wasser, das (vereinfacht) in ein Proton und ein Hydroxid-Ion dissoziiert.
Weitere protische Lösungsmittel stellen z.B. Alkohole und Carbonsäuren dar. Hier erfolgt die Abspaltung des Protons immer an der OH-Gruppe, da der elektronegative Sauerstoff die entstehende negative Ladung gut aufnehmen kann.
Das Maß, in dem das jeweilige Lösungsmittel dissoziiert, wird durch die Acidität (nach dem Säure-Base-Konzept von Brønsted und Lowry) bestimmt. Es ist zu beachten, dass auch an Kohlenstoff gebundene Wasserstoff-Atome als Protonen abgespalten werden können (CH-Acidität), die Acidität dieser Verbindungen aber meist zu gering ist, um eine nennenswerte Dissoziation in neutralem Medium zu erlauben. Die Freisetzung dieser Protonen ist nur durch sehr starke Basen möglich.
Polar protische Lösungsmittel lösen Salze und polare Verbindungen, dagegen ist die Löslichkeit unpolarer Verbindungen gering.
Protische Lösungsmittel sind:
- Wasser, das wichtigste Lösungsmittel überhaupt, insbesondere in der belebten Natur
- Methanol, Ethanol und andere Alkohole (je größer das C-Gerüst, desto weniger stark ausgeprägt ist der polare Charakter, so ist Cholesterin z.B. ein Alkohol aber dennoch stark lipophil)
- primäre und sekundäre Amine
- Carbonsäuren (Ameisensäure, Essigsäure)
- primäre und sekundäre Amide wie Formamid
- Mineralsäuren (Schwefelsäure, Halogenwasserstoffe bzw. Halogenwasserstoffsäuren)
Polaritätsskalen
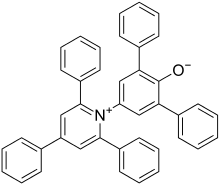
Eine bekannte Skala für die Polarität eines Lösungsmittels ist die ET(30)- oder ETN-Skala. Sie leitet sich von empirischen spektroskopischen Messungen ab. Der ET(30)-Wert ist als Übergangsenergie der längstwelligen Vis/NIR-Absorptionsbande in einer Lösung mit dem negativ solvatochromen Reichardt-Farbstoff (Betain 30) bei Normalbedingungen in kcal·mol−1 definiert. Der ETN-Wert ist der auf die Polaritätsextrema Tetramethylsilan (=0) und Wasser (=1) normalisierte ET(30)-Wert.
Tabelle mit Lösungsmitteln und ihren Daten
| Lösungsmittel | Schmelzp. [°C] |
Siedep. [°C] |
Flammp. [°C] |
Dichte [g/cm3] bei 20 °C |
Permittivität bei 25 °C |
Dipolmoment [· 10−30 Cm] |
Brechungsindex |
[kJ/mol] |
Kompressibilität [10−6 /bar] |
|---|---|---|---|---|---|---|---|---|---|
| Aceton | −95,35 | 56,2 | −19 | 0,7889 | 20,70 | 9,54 | 1,3588 | 176,4 | 126 |
| Acetonitril | −45,7 | 81,6 | 13 | 0,7857 | 37,5 (20 °C) | 11,48 | 1,3442 | 192,3 | 115 |
| Anilin | −6,3 | 184 | – | 1,0217 | 6,89 (20 °C) | 5,04 | 1,5863 | 185,2 | - |
| Anisol | −37,5 | 155,4 | – | 0,9961 | 4,33 | 4,17 | 1,5179 | 155,5 | - |
| Benzol | 5,5 | 80,1 | −8 | 0,87565 | 2,28 | 0,0 | 1,5011 | 142,2 | 95 |
| 1-Butanol | −89,8 | 117,3 | 34 | 0,8098 | 17,51 | 5,84 | 1,3993 | 209,8 | - |
| Chinolin | −15,6 | 238 | – | 1,0929 | 9,00 | 7,27 | 1,6268 | 164,7 | - |
| Chlorbenzol | −45,6 | 132 | 28 | 1,1058 | 5,62 | 5,14 | 1,5241 | 156,8 | - |
| Chloroform | −63,5 | 61,7 | – | 1,4832 | 4,81 (20 °C) | 3,84 | 1,4459 | 163,4 | 100 |
| Cyclohexan | 6,5 | 80,7 | 4,5 | 0,7785 | 2,02 (20 °C) | 0,0 | 1,4266 | 130,4 | 118 |
| Diethylether | −116,2 | 34,5 | −40 | 0,7138 | 4,34 (20 °C) | 4,34 | 1,3526 | 144,6 | - |
| Dimethylformamid | −60,5 | 153 | 67 | 0,9487 | 37,0 | 12,88 | 1,4305 | 183,1 | - |
| Dimethylsulfoxid | 18,4 | 189 | – | 1,1014 | 46,68 | 13,00 | 1,4770 | 188,1 | - |
| 1,4-Dioxan | 11,8 | 101 | 12 | 1,0337 | 2,21 | 1,5 | 1,4224 | 150,0 | - |
| Eisessig | 16,6 | 117,9 | 42 | 1,0492 | 6,15 (20 °C) | 5,60 | 1,3716 | 214,0 | - |
| Essigsäureanhydrid | −73,1 | 139,5 | – | 1,0820 | 20,7 (19 °C) | 9,41 | 1,3900 | 183,5 | - |
| Essigsäureethylester | −83,6 | 77,06 | −2 | 0,9003 | 6,02 | 6,27 | 1,3723 | 159,3 | 104 |
| Ethanol | −114,5 | 78,3 | 18 | 0,7893 | 24,55 | 5,77 | 1,3614 | 216,9 | 114 |
| Ethylendichlorid | −35,3 | 83,5 | – | 1,2351 | 10,36 | 6,2 | 1,4448 | 175,1 | - |
| Ethylenglycol | −13 | 197 | 117 | 1,1088 | 37,7 | 7,61 | 1,4313 | 235,3 | - |
| Formamid | 2,5 | 210,5 | – | 1,1334 | 111,0 (20 °C) | 11,24 | 1,4472 | 236,6 | - |
| n-Hexan | −95 | 68 | – | 0,6603 | 1,88 | 0,0 | 1,3748 | 129,2 | 150 |
| 2-Propanol (Isopropylalkohol) | −89,5 | 82,3 | 16 | 0,7855 | 19,92 | 5,54 | 1,3776 | 203,1 | 100 |
| Methanol | −97,8 | 64,7 | 6,5 | 0,7914 | 32,70 | 5,67 | 1,3287 | 232,0 | 120 |
| Methylenchlorid (Dichlormethan, DCM) | −95,1 | 40 | – | 1,3266 | 8,93 | 5,17 | 1,4242 | 171,8 | - |
| Methylethylketon (Butanon) | −86,3 | 79,6 | – | 0,8054 | 18,51 (20 °C) | 9,21 | 1,3788 | 172,6 | - |
| Nitrobenzol | 5,76 | 210,8 | 81 | 1,2037 | 34,82 | 13,44 | 1,5562 | 175,6 | - |
| Nitromethan | −28,5 | 100,8 | 35 | 1,1371 | 35,87 (30 °C) | 11,88 | 1,3817 | 193,5 | - |
| n-Pentan | −130 | 36 | −49 | 0,6262 | – | – | 1,358 | 129,7 | - |
| Petrolether/Leichtbenzin | - | ||||||||
| Piperidin | −9 | 106 | – | 0,8606 | 5,8 (20 °C) | 3,97 | 1,4530 | 148,4 | - |
| Propanol | −126,1 | 97,2 | 24 | 0,8035 | 20,33 | 5,54 | 1,3850 | 211,9 | 100 |
| Pyridin | −42 | 115,5 | 23 | 0,9819 | 12,4 (21 °C) | 7,91 | 1,5095 | 168,0 | - |
| Schwefelkohlenstoff | −110,8 | 46,3 | −30 | 1,2632 | 2,64 (20 °C) | 0,0 | 1,6319 | 136,3 | - |
| Tetrachlorkohlenstoff | −23 | 76,5 | – | 1,5940 | 2,24 (20 °C) | 0,0 | 1,4601 | 135,9 | 110 |
| Tetrahydrofuran | −108,5 | 66 | −22,5 | 0,8892 | 7,58 | 5,84 | 1,4070 | 156,3 | - |
| Toluol | −95 | 110,6 | 7 | 0,8669 | 2,38 | 1,43 | 1,4961 | 141,7 | 87 |
| Wasser | 0,0 | 100 | – | 0,9982 | 78,39 | 6,07 | 1,3330 | 263,8 | 46 |
Tabelle mit alkoholischen Lösungsmitteln und ihren Verdunstungsraten
relativ zu Essigsäure-n-butylester (= 1)
| Lösungsmittel | Siedep. [°C] |
Verdunstungsrate |
|---|---|---|
| Methanol | 65 | 2,1 |
| Ethanol | 78 | 1,6 |
| 2-Propanol | 82 | 1,4 |
| tert-Butanol | 83 | 0,95 |
| 1-Propanol | 97 | 0,86 |
| 2-Butanol | 100 | 0,81 |
| 2-Methyl-1-propanol | 108 | 0,62 |
| 1-Butanol | 118 | 0,44 |
| Cyclohexanol | 161 | 0,05 |
| 1-Octanol | 196 | 0,007 |
Indifferente Lösungsmittel
Unter einem indifferenten bzw. neutralen Lösungsmittel wird in der Polymerchemie ein Medium verstanden, das
- Abbruch- und Übertragungsreaktionen von Polymerisationen und dadurch auch Polymerisationsgeschwindigkeit und -grad wenig bis nicht beeinflusst.
- für alle Domänen eines Blockcopolymers gleiche Lösungseigenschaften aufweist (das Gegenteil ist ein selektives Lösungsmittel).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 08.11. 2025