Ethenon
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK | Schweiz: 0,5 ml/m3 bzw. 0,9 mg/m3[3] | ||||||||
Ethenon oder auch Keten (Betonung auf der zweiten Silbe: Keten) ist die einfachste chemische Verbindung aus der Gruppe der Ketene und kann als inneres Anhydrid der Essigsäure aufgefasst werden.
| Strukturformel | ||
|---|---|---|
|
| ||
| Allgemeines | ||
| Name | Ethenon | |
| Andere Namen |
| |
| Summenformel | C2H2O | |
| Kurzbeschreibung | hochentzündliches, farbloses Gas mit stechendem Geruch[1] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 207-336-9 | |
| ECHA-InfoCard | ||
| PubChem | ||
| Eigenschaften | ||
| Molare Masse | 42,04 g/mol | |
| Aggregatzustand | gasförmig | |
| Dichte | 1,93 kg/m3[1] | |
| Schmelzpunkt | −151 °C[1] | |
| Siedepunkt | −56 °C[1] | |
| Löslichkeit | hydrolysiert in Wasser[1] | |
| Thermodynamische Eigenschaften | ||
| ΔHf0 | −47,5 kJ/mol[4] | |
Gewinnung und Darstellung
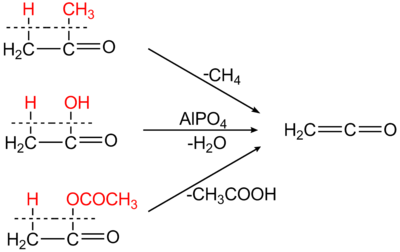
Keten entsteht durch Dehydratisierung von Essigsäure oder bei der Pyrolyse von Aceton. So wird beim Leiten von Acetondämpfen durch erhitzte Rohre oder elektrisch beheizte Metalldrähte bei 500–600 °C in Gegenwart von wenig Schwefelkohlenstoff Ethenon neben Methan in Ausbeuten bis 95 % d.Th. gebildet.[5][6] Die Ketonpyrolyse ist in der industriellen Chemie inzwischen von der Dehydratisierung von Essigsäure (Schmidlin-Bergman[7]-Wilsmore-Reaktion) weitgehend abgelöst worden.
Herstellung von Keten
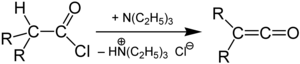
Im Labor kann Keten durch die Umsetzung von Acetylchlorid mit einem tertiären Amin dargestellt werden.
Ethenon wurde etwa zeitgleich von Hermann Staudinger[8] – durch Reaktion von Bromacetylbromid mit metallischem Zink – und Norman Thomas Mortimer Wilsmore[9] – durch thermische Zersetzung von Essigsäureanhydrid – gefunden.
Eigenschaften
Ethenon ist chemisch instabil. Das Gas ist nur bei tiefen Temperaturen (−80 °C) einigermaßen beständig. Es muss daher für jede Verwendung stets neu hergestellt und gleich weiterverarbeitet werden, da sonst eine Dimerisierung zu Diketen erfolgt bzw. eine Reaktion zu schwer handhabbaren Polymeren. Der Polymeranteil bei der Herstellung von Diketen wird daher auch z. B. durch Zugabe von Schwefeldioxid zum Ketengas oder den Reaktionsmedium verringert.[10] Wegen seiner kumulierten Doppelbindungen ist Ethenon sehr reaktiv und addiert H-azide Verbindungen nucleophil zu den entsprechenden Essigsäurederivaten; so hydrolysiert es z. B. mit Wasser zu Essigsäure oder reagiert mit prim. oder sek. Aminen zu den entsprechenden Acetamiden.
Keten ist hochgiftig; die Toxizität beträgt etwa das Achtfache von Phosgen.[11]
Verwendung
Ethenon dient zur Herstellung von Essigsäureanhydrid aus Essigsäure. Allgemein es wird zur Acetylierung von chemischen Verbindungen verwendet.[11]
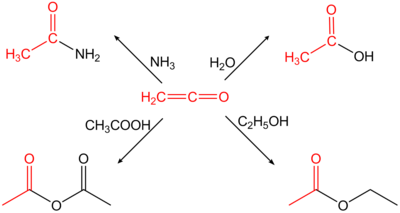
Darstellung von Acetamid, Ethylacetat, Essigsäure und Essigsäureanhydrid
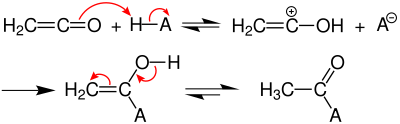
Mechanismus der Umsetzung von Keten mit einem Protonendonator H–A
Ethenon reagiert mit Formaldehyd in Gegenwart von Lewis-Säuren wie AlCl3, ZnCl2 oder BF3 als Katalysatoren zu β-Propiolacton.[12] Die technisch bedeutendste Verwendung von Ethenon ist die Synthese von Sorbinsäure durch Reaktion von Crotonaldehyd (2-Butenal) mit Keten in Toluol bei ca. 50 °C in Anwesenheit von Zinksalzen langkettiger Carbonsäuren. Dabei entsteht ein Polyester der 3-Hydroxy-4-hexensäure, der thermisch[13] oder hydrolytisch zu Sorbinsäure depolymerisiert wird.
Sicherheitshinweise
Ethenon neigt zur spontanen Polymerisation. Der Kontakt mit Wasserstoffperoxid führt zu explosivem Diacetylperoxid.[14] Die Dämpfe von Keten können mit Luft ein explosionsfähiges Gemisch bilden.
Einzelnachweise
- ↑ Hochspringen nach: a b
c d e Eintrag zu
 Keten in der GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung.
Keten in der GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung.
- ↑ Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch
Inverkehrbringer abgeleitete Kennzeichnung von
 Ketene im Classification and Labelling Inventory der
Europäischen Chemikalienagentur (ECHA).
Ketene im Classification and Labelling Inventory der
Europäischen Chemikalienagentur (ECHA).
- ↑ Schweizerische Unfallversicherungsanstalt (Suva):
 Grenzwerte – Aktuelle MAK- und BAT-Werte
(Suche nach 463-51-4 bzw. Keten).
Grenzwerte – Aktuelle MAK- und BAT-Werte
(Suche nach 463-51-4 bzw. Keten).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-21.
- ↑ K.-H. Lautenschläger, W. Schröter, A. Wanninger, "Taschenbuch der Chemie", 20. Aufl. 2006, ISBN 978-3-8171-1761-1.
- ↑ C.D. Hurd:
 Ketene In: Organic Syntheses. 4, 1925, S. 39,
doi:
Ketene In: Organic Syntheses. 4, 1925, S. 39,
doi: 10.15227/orgsyn.004.0039;
Coll. Vol. 1, 1941, S. 330 (
10.15227/orgsyn.004.0039;
Coll. Vol. 1, 1941, S. 330 ( PDF).
PDF).
- ↑ J. Schmidlin, M. Bergman, Ber. dtsch. Chem. Ges., 43, 2821 (1910),
 DOI:10.1002/cber.19100430340.
DOI:10.1002/cber.19100430340.
- ↑ Tidwell, T. T. (2005), Ein Jahrhundert Ketene (1905–2005): die Entdeckung einer vielseitigen Klasse reaktiver
Intermediate. Angewandte Chemie, 117: 5926–5933.
 doi:10.1002/ange.200500098 und H. Staudinger, H. W. Klever, Ber. dtsch. Chem.
Ges., 41, 5943 (1908).
doi:10.1002/ange.200500098 und H. Staudinger, H. W. Klever, Ber. dtsch. Chem.
Ges., 41, 5943 (1908).
- ↑ N. T. M. Wilsmore, J. Chem. Soc., 91, 1938 (1907),
 DOI:10.1039/ct9079101938.
DOI:10.1039/ct9079101938.
- ↑ Patent
 EP0377438: Veröffentlicht am
11. Juni 1990, Anmelder: Lonza AG, Erfinder: R. Bergamin et al..
EP0377438: Veröffentlicht am
11. Juni 1990, Anmelder: Lonza AG, Erfinder: R. Bergamin et al..
- ↑ Hochspringen nach: a b Eintrag zu Diketen. In: Römpp Online. Georg Thieme Verlag.
- ↑ Hans-Jürgen Arpe, "Industrielle Organische Chemie", 6. Aufl., 2007, WILEY-VCH Verlag, Weinheim, ISBN 978-3-527-31540-6.
- ↑ Patent
 EP1295860: Veröffentlicht am
26. März 2003, Anmelder: Nutrinova GmbH, Erfinder: D. Decker et al..
EP1295860: Veröffentlicht am
26. März 2003, Anmelder: Nutrinova GmbH, Erfinder: D. Decker et al..
- ↑ L. Roth, U. Weller-Schäferbarthold: Gefährliche Chemische Reaktionen - Potentiell gefährliche chemische Reaktionen zu über 1750 Stoffen, Eintrag für Keten, CD-ROM Ausgabe 8/2021, ecomed Sicherheit Landsberg/Lech, ISBN 978-3-609-48040-4.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 21.08. 2024