
Ethylendiamintetraessigsäure
| Sicherheitshinweise | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
| Toxikologische Daten | 4500 mg/kg (LD50, Ratte, oral)[2] | |||||||||
Ethylendiamintetraessigsäure bzw. Ethylendiamintetraacetat, das Tetraanion der Ethylendiamintetraessigsäure, ist ein sechszähniger Komplexbildner und bildet besonders stabile 1:1-Chelatkomplexe mit Kationen mit einer Ladungszahl von mindestens +2. Die Abkürzung EDTA steht sowohl für die deutsche Bezeichnung Ethylendiamintetraacetat als auch für die englische Bezeichnung Ethylenediaminetetraacetic acid. Pionierarbeit zu EDTA leistete Gerold Schwarzenbach in den 1940er-Jahren an der Universität Zürich. Die Erstsynthese von EDTA gelang 1935 Ferdinand Münz bei der IG Farben[7], der ein Verfahren hierzu auch patentieren ließ.[8]
| Strukturformel | ||
|---|---|---|
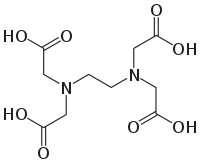
| ||
| Allgemeines | ||
| Freiname | Edetinsäure | |
| Andere Namen | ||
| Summenformel | C10H16N2O8 | |
| Kurzbeschreibung | farbloser Feststoff[2] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 200-449-4 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| DrugBank | ||
| Arzneistoffangaben | ||
| ATC-Code | ||
| Eigenschaften | ||
| Molare Masse | 292,24 g/mol | |
| Aggregatzustand |
fest | |
| Dichte | 1,46 g·cm−3 (20 °C)[3] | |
| Schmelzpunkt | 245 °C (Zersetzung)[4][3] | |
| pKS-Wert | ||
| Löslichkeit |
| |
Eigenschaften
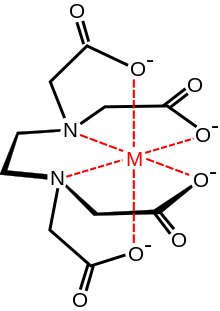
Das Ethylendiamintetraessigsäure-Anion kann neben den beiden freien Elektronenpaaren der Stickstoffatome auch vier Carboxygruppen für eine Komplexverbindung zur Verfügung stellen, es kann sich also 6-fach an ein Kation binden. Auf diese Weise vermag es, sehr stabile Komplexe auch mit solchen Kationen zu bilden, die, wie beispielsweise Calcium, eine äußerst geringe Tendenz zur Bildung von Komplexen haben. Komplexe dieser Art bezeichnet man auch als Chelatkomplexe, von lateinisch Chela bzw. griechisch Chele, Krebsschere. EDTA bildet besonders stabile Komplexe mit Cu2+, Ni2+, Fe3+ und Co2+. In saurem pH-Wert liegt EDTA in verschiedenen Säureformen vor, die weniger dissoziiert sind. Die Säure löst sich daher langsam, vor allem bei niedrigem pH-Wert, die Salze sind dagegen sehr schnell in Wasser löslich. In Fetten ist EDTA nicht löslich. Die pKS-Werte sind je nach Quelle 0,26, 0,96, 2,60 und 2,76 (für die Deprotonierung der vier Carboxygruppen)[5] beziehungsweise 0, 1,5, 2 und 2,66 (für die Deprotonierung der vier Carboxygruppen) sowie 6,16 und 10,24 (für die Protonierung der zwei Aminogruppen).[9]
Synthese
Durch die Strecker-Synthese von Formaldehyd und Blausäure mit Ethylendiamin über das Tetranitril und anschließender alkalischer Hydrolyse.[10]
Verwendung
EDTA ist einer der am häufigsten verwendeten Komplexbildner. 1999 wurden in Europa rund 35.000 Tonnen, in den USA 50.000 Tonnen verbraucht.
Neben der freien Säure werden vielfach auch deren Salze verwendet:
- Dinatrium-ethylendiamin-tetraacetat (Na2H2EDTA, Natriumedetat, INS 386)
- Tetranatrium-ethylendiamin-tetraacetat (Na4EDTA)
- Calcium-dinatrium-ethylendiamin-tetraacetat (CaNa2EDTA, E 385)
Die wichtigsten Anwendungen von EDTA und deren Salzen sind
- Detergenzien: EDTA ist in vielen Wasch- und Reinigungsmitteln zur Bindung von Ca2+- und Mg2+-Ionen (Enthärtung) enthalten (es sollte aber nicht mit dem auch dort eingesetzten TAED verwechselt werden).
- Industrielle Reinigung: Komplexierung zweiwertiger Kationen wie Ca2+ und Mg2+ sowie einiger Schwermetallionen
- Photoindustrie: FeIII-EDTA ist ein wichtiger Bestandteil (Oxidationsmittel für das metallische Silber) in der Farbentwicklung.
- Papierindustrie: Zur Komplexierung von Fe3+- und Mn2+-Ionen, die bei der chlorfreien Bleiche das Wasserstoffperoxid zersetzen
- Agrochemikalien: FeIII-, CuII- und ZnII-EDTA werden als Dünger verwendet, vor allem auf kalkhaltigen Böden
- Konservierungsmittel: EDTA komplexiert zweiwertige Metallkationen, die für die Funktion vieler Enzyme essenziell sind. Die Vermehrung von Bakterien wird so unter anderem in Kontaktlinsen-Pflegemitteln verhindert.
Weitere Verwendungen von EDTA sind:
- Textilindustrie: Stabilisierung von Bleichbädern
- Kosmetika: als Konservierungsstoff und um Verfärbungen durch Metalle in klaren Produkten zu vermeiden.
- Medizin: Behandlung von Metallvergiftungen, Chelat-Therapie. Umstritten ist alternativmedizinische Chelat-Therapie, bei der EDTA injiziert wird, um den Körper zu „reinigen“. In der diagnostischen Medizin wird EDTA als Calciumchelator eingesetzt und dient der Antikoagulation von Blutproben.
- In der Zahnmedizin verwendet man EDTA-Lösungen bei Wurzelkanalbehandlungen, um die bei der Aufbereitung des Wurzelkanales entstehende Schmierschicht zu entfernen und die Dentinkanälcheneingänge freizulegen.
Seine Calcium-Natriumsalze werden ebenfalls eingesetzt:
- Calciumdinatriumethylendiamintetraacetat wird als Antioxidationsmittel, Stabilisator und Komplexbildner verwendet. Durch die Bindung von Metallionen verhindert es eine Farbveränderung bei Lebensmitteln in Konservendosen. Öle werden aus gleichem Grund am Ranzigwerden gehindert. Es ist in der EU als Lebensmittelzusatzstoff der Bezeichnung E 385 nur für emulgierte Saucen, Dosen- und Glaskonserven, Halbfettmargarine sowie Schalentiere zugelassen.[11] In Australien hat es keine Zulassung.
- Calciumdinatriumethylendiamintetraacetat wird in der Medizin ebenfalls als blutgerinnungshemmender Zusatzstoff für Blutabnahmen verwendet. Des Weiteren wird es als Medikamentenzusatz gegen Schwermetallvergiftungen, Herz-Kreislauf-beschwerden, Rheuma und Arthritis verabreicht. Weitere mögliche medizinische Einsatzgebiete sind Arteriosklerose und Durchblutungsstörungen.
In der Chemie oder Biologie wird EDTA vielfach verwendet.
-ion.png)
- In der Analytischen Chemie (quantitative Analyse) wird EDTA als Komplexon / Titriplex II-Maßlösung dazu benutzt, in der Chelatometrie die Wasserhärte oder einzelne Metallionen wie Cu, Pb, Hg, Ca oder Mg quantitativ zu bestimmen. Auch das in Wasser besser lösliche Dinatriumsalz (Komplexon/Titriplex III) kann verwendet werden.
- EDTA ist einer der Bestandteile der TAE- und TBE-Puffer, die unter anderem bei der Gelelektrophorese, etwa zur Trennung von DNA-Fragmenten, Verwendung finden.
- Enzymlösungen werden oft mit EDTA versetzt, um der durch Schwermetallionen verursachten Hemmung der Enzymaktivität vorzubeugen.
- Pflanzennährlösungen wird EDTA zugefügt, um eine Fällung des benötigten Eisens mit dem ebenfalls benötigten Phosphat als Eisenphosphat zu verhindern.
- Bei der Abtötung gramnegativer Bakterien mit Lysozym wird EDTA zur Permeabilisierung der Außenmembran (plastische Schichte) hinzugegeben, teilweise auch bei einem Zellaufschluss.
- Auch lassen sich Metalloproteasen durch Chelatbildner wie EDTA inhibieren. Durch die Chelatisierung der Metallionen aus dem Aktivzentrum von Metalloproteasen verlieren diese ihre katalytische Aktivität.
Biologische Abbaubarkeit, Toxikologie und Allergien
EDTA und seine Metallkomplexe sind in der Abwasserreinigung nicht oder nur schlecht biologisch abbaubar. Durch Erhöhen des pH-Wertes und Verlängerung des Schlammalters kann jedoch eine weitgehende biologische Eliminierung von EDTA erreicht werden. Aus Klärschlamm, Sedimenten und Böden wurde eine Vielzahl von Mikroorganismen isoliert, die mit EDTA als alleiniger C- und N-Quelle wachsen können. Die Metallkomplexe von EDTA sind nicht oder nur sehr wenig toxisch für Organismen. EDTA vermag jedoch auch schwerlösliche Schwermetallsalze aus den Sedimenten zu lösen. Wenn das EDTA dann zerfällt, werden diese an der Oberfläche wieder frei.
Auch die Toxizität von EDTA für den Menschen ist sehr gering, sodass EDTA als Lebensmittelzusatzstoff zugelassen ist. In sehr hohen Konzentrationen kann vor allem freies EDTA durch Bindung lebenswichtiger Metalle zu Störungen führen. Die in der Umwelt gemessenen Konzentrationen von EDTA sind für den Menschen unbedenklich. Gleichwohl kann es zu Stoffwechselbeeinträchtigungen oder (haut-)allergischen Reaktionen kommen.[12][13][14]
Es wurden bereits Bakterien zum Einsatz von biotechnologischen Verfahren zum Abbau von EDTA untersucht. Arten wie Chelativorans multitrophicus und Chelativorans oligotrophicus können EDTA-Verbindungen im Stoffwechsel nutzen und könnten für den Abbau von EDTA eingesetzt werden.[15]
Umweltverhalten
EDTA gelangt fast ausschließlich über das Abwasser in die Umwelt. Da EDTA unter normalen Bedingungen nur sehr langsam abgebaut wird,[16] kann es in praktisch allen Wasserproben in niedrigen Konzentrationen nachgewiesen werden.[17] EDTA-Konzentrationen in Flüssen liegen zwischen 10 und 100 µg/l, in Seen zwischen 1 und 10 µg/l. Im Grundwasser und Uferfiltrat kann EDTA in Konzentrationen zwischen 1 und 100 µg/l gefunden werden. Bei neutralen pH-Werten ist die Adsorption von EDTA an Mineraloberflächen gering, was zu einer hohen Mobilität im Grundwasser führt. Lediglich der FeIII-EDTA-Komplex wird sehr schnell durch Sonnenlicht abgebaut. Dies ist der wichtigste Eliminationsprozess für EDTA in der Umwelt. EDTA wird während der Ozonisierung oder Chlorung von Trinkwasser nur unvollständig entfernt. Negative Umweltauswirkungen von EDTA haben wenig mit dessen spezifischer Toxizität zu tun, sondern vielmehr mit den komplexierenden Eigenschaften, die in Wechselwirkung mit anderen Stoffen (insbesondere Schwermetalle, Härtebildner und Mikronährstoffe), auftreten, diese beispielsweise aus dem Sediment lösen und so bioverfügbar machen können.[17]
Das deutsche Umweltbundesamt empfiehlt: „Im Sinne einer vorsorgenden Stoffpolitik sollten EDTA und auch andere schwer abbaubare Komplexbildner wie Diethylentriaminpentaessigsäure (DTPA) oder Propylendiamintetraessigsäure (PDTA) durch Stoffe ersetzt werden, die möglichst leicht abbaubar sind und somit in Kläranlagen entfernt werden können.“ Mögliche Ersatzstoffe sind Nitrilotriessigsäure (NTA) und ihre Natriumsalze, Citrate, Gluconate, β-Alanindiessigsäure-Natriumsalz (ADA), Methylglycindiessigsäure (MGDA), u.a.m. In der Schweiz ist das Inverkehrbringen von Wasch- bzw. Reinigungs- und Desodorierungsmitteln mit einem Massengehalt von mehr als 0,5 % bzw. 1 % EDTA bzw. seiner Salze verboten.
Ersatzstoffe
- Nitrilotriessigsäure (NTA)
- Ethylenglycol-bis(aminoethylether)-N,N,N′,N′-tetraessigsäure (EGTA)
- Ethylendiamindibernsteinsäure (EDDS)
- Citronensäure
- Polycarboxylate
- Zeolithe, insbesondere Zeolith A
- Phosphonsäuren, Phosphonate
Einzelnachweise
- ↑ Eintrag zu
 EDTA
in der CosIng-Datenbank der EU-Kommission.
EDTA
in der CosIng-Datenbank der EU-Kommission.
- ↑ Hochspringen nach: a b c Eintrag zu Ethylendiamintetraessigsäure. In: Römpp Online. Georg Thieme Verlag.
- ↑ Hochspringen nach: a b
c d
e Eintrag zu
 Ethylendiamintetraessigsäure in der GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung.
Ethylendiamintetraessigsäure in der GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung.
- ↑ Eintrag zu
 Edetic acid in der ChemIDplus-Datenbank
der United States National Library of Medicine (NLM).
Edetic acid in der ChemIDplus-Datenbank
der United States National Library of Medicine (NLM).
- ↑ Hochspringen nach: a b c
d e Ethylendiamintetraessigsäure (EDTA) und ihre Alkalisalze [MAK Value Documentation in
German language, 2009]. In: MAK, 46. Lieferung, 2009,
 DOI:10.1002/3527600418.mb6000d0046. S. 1.
DOI:10.1002/3527600418.mb6000d0046. S. 1.
- ↑ Eintrag zu
 Edetic acid im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
Edetic acid im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
 erweitern.
erweitern.
- ↑ Paolieri Matteo:
 Ferdinand Münz: EDTA and 40 years of inventions In:
ACS Bulletin for the History of Chemistry. 42(2), 2017, S. 133–140.
Ferdinand Münz: EDTA and 40 years of inventions In:
ACS Bulletin for the History of Chemistry. 42(2), 2017, S. 133–140.
- ↑ Patent
 US2130505A:
Polyamino carboxylic acids and process of making same. Angemeldet am 3. April 1937,
veröffentlicht am 20. September 1938, Anmelder: General Aniline Works Inc, Erfinder: Ferdinand Munz.
US2130505A:
Polyamino carboxylic acids and process of making same. Angemeldet am 3. April 1937,
veröffentlicht am 20. September 1938, Anmelder: General Aniline Works Inc, Erfinder: Ferdinand Munz.
- ↑ Hans Peter Latscha: Analytische Chemie. Springer-Verlag, 2013, ISBN 978-3-642-18493-2, S. 303.
- ↑ Beyer/Walter: Lehrbuch der organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart 1981.
- ↑
 Verordnung (EG) Nr. 1333/2008 in der konsolidierten Fassung vom 31. Oktober 2022.
Verordnung (EG) Nr. 1333/2008 in der konsolidierten Fassung vom 31. Oktober 2022.
- ↑
 Ethylendiamintetraessigsäure (EDTA) und ihre Alkalisalze MAK Value Documentation in
German language, 2009
Ethylendiamintetraessigsäure (EDTA) und ihre Alkalisalze MAK Value Documentation in
German language, 2009
- ↑
 Calcium-Dinatrium-EDTA auf codecheck.de
Calcium-Dinatrium-EDTA auf codecheck.de
- ↑
 EDTA-Allergie: Symptome Ursachen und Tipps.
EDTA-Allergie: Symptome Ursachen und Tipps.
- ↑
Nina V. Doronina, Elena N. Kaparullina, Yuri A. Trotsenko, Bernd Nörtemann, Margarete Bucheli-Witschel, Hans-Ueli Weilenmann und Thomas Egli:
Chelativorans multitrophicus gen. nov., sp. nov. and Chelativorans oligotrophicus sp. nov., aerobic EDTA-degrading bacteria
In: International Journal of Systematic and Evolutionary Microbiology (2010), Band 60, S. 1044–1051
doi:
 10.1099/ijs.0.003152-0
10.1099/ijs.0.003152-0
- ↑
 Trinkwasserbericht Nordrhein-Westfalen 2008 des Ministeriums für Umwelt und Naturschutz,
Landwirtschaft und Verbraucherschutz des Landes Nordrhein-Westfalen.
Trinkwasserbericht Nordrhein-Westfalen 2008 des Ministeriums für Umwelt und Naturschutz,
Landwirtschaft und Verbraucherschutz des Landes Nordrhein-Westfalen.
- ↑ Hochspringen nach: a b
 Auswertungsbericht Komplexbildner der Internationale
Kommission zum Schutz des Rheins (IKSR) 2012.
Auswertungsbericht Komplexbildner der Internationale
Kommission zum Schutz des Rheins (IKSR) 2012.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.11. 2025

