Ammoniumacetat
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Ammoniumacetat, CH3COONH4, ist das Ammoniumsalz der Essigsäure. Es bildet farblose, schwach nach Essigsäure riechende Kristalle, die sich sehr gut in Wasser und gut in Ethanol lösen. Im festen Zustand bildet es eine hygroskopische Masse, die in Lösung neutral reagiert.
Synthese
| Strukturformel | ||
|---|---|---|
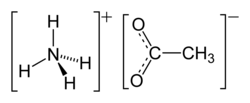
| ||
| Allgemeines | ||
| Name | Ammoniumacetat | |
| Andere Namen | AMMONIUM ACETATE (INCI)[1] | |
| Summenformel | C2H7NO2 | |
| Kurzbeschreibung | farblose Kristalle[2] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 211-162-9 | |
| ECHA-InfoCard | ||
| PubChem | ||
| Eigenschaften | ||
| Molare Masse | 77,08 g/mol−1 | |
| Aggregatzustand | fest | |
| Dichte | 1,17 g/cm3[3] | |
| Schmelzpunkt | 114 °C[3] | |
| Siedepunkt | Zersetzung ab 90 °C[3] | |
| Löslichkeit | ||
Ammoniumacetat lässt sich durch Umsetzung von Ammoniumcarbonat oder Ammoniak mit Eisessig gewinnen.
Verwendung
Verwendung findet das Ammoniumacetat in der Färberei, bei der Fleischkonservierung und in der biochemischen Laborarbeit. Im Labor wird es zur Herstellung von Pufferlösungen zur Stabilisierung des pH-Werts verwendet. Die Dissoziationskonstanten von Ammoniak und Essigsäure in Wasser sind nahezu identisch; Lösungen von Ammoniumacetat haben deshalb relativ unabhängig von der Konzentration einen pH-Wert von 7,0[5]. In der Mikroskopie wird es in Mischung mit Gummi arabicum als Einschlussmittel zur Herstellung von Dauerpräparaten eingesetzt.
In der Gentechnik wird die DNA manchmal mit Hilfe von Ammoniumacetat ausgefällt. Im Gegensatz zu Natriumacetat werden so keine Oligonukleotide und keine freien dNTPs mitgefällt, so dass auf diese Art gefällte DNA für die Transfektion von Säugerzellen besser geeignet ist. Sie ist allerdings nicht geeignet, wenn später Kinasen verwendet werden sollen.
Reaktionen
Beim Erhitzen zerfällt Ammoniumacetat unter Wasserabspaltung zu Acetamid.[6]
In der organischen Synthese wird die Verbindung als Reagenz zur Einführung von Stickstoff in organische Moleküle verwendet.[6] Die Umsetzung mit Alkoholen ergibt tertiäre Amine.[7][6]
Eine Eintopfreaktion mit substituierten Benzoinen, 1,3-Dicarbonylverbindungen und Ammoniumacetat führt ohne Lösungsmittel und Katalysator zu tetrasubstituierten Pyrrolen.[8][6]

Als Variante der Hantzschschen Dihydropyridinsynthese können durch die Umsetzung von β-Ketocarbonsäureestern, Aldehyden und Ammoniumacetat substituierte 1,4-Dihydropyridine erhalten werden.[9][6]

Einzelnachweise
- ↑ Eintrag zu
 AMMONIUM ACETATE in der
CosIng-Datenbank der EU-Kommission.
AMMONIUM ACETATE in der
CosIng-Datenbank der EU-Kommission.
- ↑ Europäisches Arzneibuch 10.0. Deutscher Apotheker Verlag, 2020, ISBN 978-3-7692-7515-5, S. 701.
- ↑ Hochspringen nach: a
b c d
e f Eintrag zu
 Ammoniumacetat in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung,
. (JavaScript erforderlich)
Ammoniumacetat in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung,
. (JavaScript erforderlich)
- ↑ Eintrag zu Ammoniumacetat. In: Römpp Online. Georg Thieme Verlag.
- ↑ R. J. Williams, C. M. Lyman:
A Neutral Buffered Standard for Hydrogen Ion Work and Accurate Titrations Which Can be Prepared in One Minute. In: J. Am. Chem. Soc. 54(5), 1932, S. 1911–1912.
 doi:10.1021/ja01344a025
doi:10.1021/ja01344a025
- ↑ Hochspringen nach: a b c d e Ammonium acetate. In: e-EROS Encyclopedia of Reagents for Organic Synthesis. John Wiley and Sons, 1999–2013.
- ↑ R. Yamaguchi, S. Kawagoe, C. Asai, K. Fujita: Selective Synthesis of Secondary and Tertiary Amines
by Cp*Iridium-Catalyzed Multialkylation of Ammonium Salts with Alcohols. In: Org. Lett. 10, 2008, S. 181–184.
 doi:10.1021/ol702522k.
doi:10.1021/ol702522k.
- ↑ S. I. Bhat, D. R. Trivedi: A catalyst- and solvent-free three-component reaction for the
regioselective one-pot access to polyfunctionalized pyrroles. In: Tetrahedron Lett. 54, 2013, S. 5577–5582.
 doi:10.1016/j.tetlet.2013.07.153.
doi:10.1016/j.tetlet.2013.07.153.
- ↑ K. Azizi, J. Azarnia, M. Karimi, E. Yazdani, A. Heydari: Novel Magnetically Separable Sulfated
Boric Acid Functionalized Nanoparticles for Hantzsch Ester Synthesis. In: Synlett. 27, 2016, S. 1810–1813.
 doi:10.1055/s-0035-1561441.
doi:10.1055/s-0035-1561441.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 09.05. 2024