Diphenylamin
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK | Schweiz: 10 mg/m3 (gemessen als einatembarer Staub)[4] | ||||||||
| Toxikologische Daten | 1120 mg/g (LD50, Ratte, oral)[2] | ||||||||
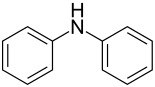
Diphenylamin oder auch N-Phenylanilin ist eine aromatische organische Verbindung mit der Summenformel C12H11N. Es gehört zur Stoffklasse der sekundären Amine.
| Strukturformel | ||
|---|---|---|
| ||
| Allgemeines | ||
| Name | Diphenylamin | |
| Andere Namen |
| |
| Summenformel | C12H11N | |
| Kurzbeschreibung | farblose, blättrige, schwach blumig riechende Kristalle[1] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | | |
| EG-Nummer | 204-539-4 | |
| ECHA-InfoCard | 100.004.128 | |
| PubChem | | |
| ChemSpider | | |
| Eigenschaften | ||
| Molare Masse | 169,23 g/mol | |
| Aggregatzustand | fest[2] | |
| Dichte | 1,16 g/cm3[2] | |
| Schmelzpunkt | 53 °C[2] | |
| Siedepunkt | 302 °C[2] | |
| Dampfdruck | 0,33 Pa bei 20 °C[2] | |
| Löslichkeit | ||
Vorkommen
Diphenylamin kommt als Naturstoff in Zwiebeln, schwarzem und grünen Tee und in Schalen von Citrusfrüchten vor.[5]
Herstellung
Diphenylamin wird technisch durch oxid-katalysierte Desaminierung von Anilin hergestellt.
Eigenschaften
Physikalische Eigenschaften
Diphenylamin bildet farblose bis graue, lichtempfindliche, blättrige Kristalle mit blumigem Geruch.[2]
Chemische Eigenschaften
Diphenylamin ist ein Redoxindikator. Ein Farbwechsel findet statt zwischen oxidierter Form (blauviolett) und reduzierter Form (farblos).
Thermisch oder photochemisch kann Diphenylamin durch oxidativen intramolekularen Ringschluss zu Carbazol reagieren.
Als aromatisches Amin reagiert Diphenylamin zwar als schwache Base, kann aber auch selbst von starken Basen zum (mesomeriestabilisierten) Diphenylamid-Anion deprotoniert werden.
Verwendung
Diphenylamin wird in der Landwirtschaft als Fungizid eingesetzt.[6] Diphenylamin hemmt die Oxidation des Terpens α-Farnesen.[7] Bei der Bekämpfung der Schalenbräune spielte es eine wichtige Rolle.[8] In den Staaten der EU und in der Schweiz sind keine Pflanzenschutzmittel mit diesem Wirkstoff zugelassen.[9]
Diphenylamin dient zum Nachweis von Nitrit-, Nitrat- und Chlorationen. Dabei wird es zu Tetraphenylhydrazin dimerisiert, das dann eine Benzidin-Umlagerung eingeht und zu einem farbigen chinoiden System (Chinoniminfarbstoff) oxidiert wird. Diese Nachweisreaktion wird beim Paraffintest eingesetzt, mit dem der Gebrauch von Schusswaffen nachgewiesen werden kann.
Diphenylamin (DPA) ist einer der am meisten verwendeten Stabilisatoren für Schießpulver. Seine Aufgabe ist das Abfangen von nitrosen Gasen (NOx) und sauren Bestandteilen. Es wurde daher anfänglich auch bei der Herstellung von Ballistit eingesetzt. Dabei wandelt es sich in das als Karzinogen verdächtige N-Nitrosodiphenylamin um. DPA ist mit Nitroglycerin (NG) unverträglich. Ab einem Nitroglyceringehalt von 20 % (häufig auch schon darunter) werden andere Stabilisatoren (Centrali, 2-Nitro-DPA oder Akardit) eingesetzt. Auch mit Kaliumnitrat ist DPA nicht verträglich.
Ferner kann es zur Herstellung von Farbstoffen[10] (wie Acid Yellow 36, Acid Yellow 63 und Acid Orange 5) und in Kautschukherstellung als Antioxidans und Vulkanisationsbeschleuniger verwendet werden.
Diphenylamin eignet sich auch zum Stabilisieren von Ethern.
Diphenylamin mit konzentrierter Schwefelsäure in Eisessig (Dische-Reagenz) reagiert mit Desoxyribosen beim Erhitzen zu einem blauen Farbstoff.
Arylierung mit Iodbenzol führt zu Triphenylamin.[11]
Pharmakologische Bedeutung
Trizyklische Diphenylamin-Derivate wurden ab den 1960er Jahren als Antidepressiva eingesetzt.[12] Diphenylamin wirkt stark blutzuckersenkend.
Sicherheitshinweise
Diphenylamin ist giftig beim Einatmen, Verschlucken und Berührung mit der Haut. Es besteht die Gefahr kumulativer Wirkungen. Bei Kontakt treten lokale Reizungen von Haut, Augen und Atemwegen auf. Die Hautresorption ist gering. Nach Resorption großer Mengen tritt Methämoglobinbildung auf.
Bei Aufnahme in den Körper sind irreversible schwere Gesundheitsschäden bis zur Todesfolge zu erwarten. Deshalb ist jeglicher Kontakt zum menschlichen Körper zu vermeiden.
Diphenylamin darf nicht mit Hexachlormelamin, Trichlormelamin und Oxidationsmitteln in Berührung gebracht werden. Im Brandfall treten gefährliche Zersetzungsprodukte auf wie nitrose Gase und Amine.
Diphenylamin sollte wegen der photochemischen Bildung von Carbazol unter Lichtschutz gelagert werden. Schutzhandschuhe bieten kurzzeitigen Staubschutz.
Einzelnachweise
- ↑ Hochspringen nach: a b Eintrag zu Diphenylamin. In: Römpp Online. Georg Thieme Verlag.
- ↑ Hochspringen nach: a b
c d e
f g h
i j Eintrag zu
 Diphenylamin in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
Diphenylamin in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
- ↑ Eintrag zu
 Diphenylamine im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
Diphenylamine im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
 erweitern.
erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva):
 Grenzwerte – Aktuelle MAK- und BAT-Werte
(Suche nach 122-39-4 bzw. Diphenylamin).
Grenzwerte – Aktuelle MAK- und BAT-Werte
(Suche nach 122-39-4 bzw. Diphenylamin).
- ↑ Oliver Drzyzga: Umweltrelevanz von Diphenylamin — Ein Stoff der 3. EU-Altstoffprioritätenliste. In:
Umweltwissenschaften und Schadstoff-Forschung. 11, 1999, S. 365,
doi:
 10.1007/BF03037729.
10.1007/BF03037729.
- ↑
 alanwood
(British Crop Production Council)
alanwood
(British Crop Production Council)
- ↑ F. E. Huelin, I. M. Coggiola: Superficial scald, a functional disorder of
stored apples. V. – Oxidation of α-farnesene and its inhibition by diphenylamine. In: Journal of the Science of Food and Agriculture.
Band 21, Nr. 1, Januar 1970,
S. 44–48,
doi:
 10.1002/jsfa.2740210113.
10.1002/jsfa.2740210113.
- ↑ Schalenbräune – Vorbeugung ohne Diphenylamin (Versuchszentrum Laimburg)
- ↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu
 Diphenylamine
in der EU-Pestiziddatenbank.
Diphenylamine
in der EU-Pestiziddatenbank.
- ↑
 Datenblatt bei Lanxess
(vom 14. Oktober 2018 im Internet Archive).
Datenblatt bei Lanxess
(vom 14. Oktober 2018 im Internet Archive).
- ↑ F. D. Hager:
 Triphenylamine In: Organic Syntheses. 8, 1928, S. 116,
doi:
Triphenylamine In: Organic Syntheses. 8, 1928, S. 116,
doi:  10.15227/orgsyn.008.0116;
Coll. Vol. 1, 1941, S. 544 (
10.15227/orgsyn.008.0116;
Coll. Vol. 1, 1941, S. 544 (  PDF).
PDF).
- ↑ Gustav Ehrhart/Heinrich Ruschig: Arzneimittel, 1968, S. 446 f.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 17.05. 2025


