Helium
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Helium (ἥλιος hélios, deutsch ‚Sonne‘) ist ein chemisches Element mit dem Elementsymbol He und der Ordnungszahl 2. Im Periodensystem steht es in der 18. Gruppe (früher 8. Hauptgruppe) und zählt damit zu den Edelgasen. Es ist ein farbloses, geruchloses, geschmacksneutrales, ungiftiges Gas.
Helium bleibt bis zu sehr tiefen Temperaturen gasförmig, erst nahe dem absoluten Nullpunkt wird es flüssig. Es ist die einzige Substanz, die bei Normaldruck selbst am absoluten Nullpunkt (0 K bzw. −273,15 °C) nicht fest wird. Helium ist die Substanz mit der größten bekannten chemischen Reaktionsträgheit. Auch unter Extrembedingungen konnten bis jetzt keine Verbindungen des Heliums nachgewiesen werden, die nicht sofort nach der Bildung zerfallen. Soweit bekannt, kommt Helium nur atomar vor. Das häufigste stabile Isotop ist 4He; ein weiteres stabiles Isotop ist das sehr seltene 3He.
Das Verhalten der beiden flüssigen Phasen Helium I rsp. Helium-I sowie Helium II bzw. Helium-II (insbesondere das Phänomen der Suprafluidität) von 4He ist Gegenstand aktueller Forschungen auf dem Gebiet der Quantenmechanik. Weiterhin ist flüssiges Helium ein unverzichtbares Hilfsmittel zur Erzielung der tiefsten Temperaturen, die unter anderem zur Kühlung von Infrarotdetektoren von Weltraumteleskopen und zur Untersuchung von Eigenschaften wie zum Beispiel der Supraleitung von Materie bei Temperaturen nahe dem absoluten Nullpunkt erforderlich sind.
Der größte Teil des interstellaren Heliums ist schon beim Urknall entstanden. Das im Inneren von Sternen durch Fusion von Wasserstoff entstandene Helium fusionierte zum größten Teil weiter zu schwereren Elementen.
Auf der Erde wird 4He in Form von Alphateilchen bei dem Alphazerfall verschiedener radioaktiver Elemente wie zum Beispiel Uran oder Radium gebildet. Helium entsteht, wenn Alphateilchen anderen Atomen zwei Elektronen entreißen. Der Großteil des auf der Erde vorhandenen Heliums ist daher nicht-stellaren Ursprungs. Das so entstandene Helium sammelt sich in natürlichen Erdgas-Vorkommen in Konzentrationen bis zu sieben Volumenprozent. Daher kann Helium durch Fraktionierte Destillation aus Erdgas gewonnen werden.
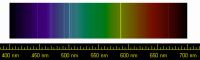
Erste Hinweise auf Helium wurden 1868 durch den französischen Astronomen Jules Janssen bei Untersuchungen des Lichtspektrums der Chromosphäre der Sonne entdeckt, wobei er die bis dahin unbekannte gelbe Spektrallinie von Helium fand.
Geschichte
Hinweise auf das Element Helium erhielt man zum ersten Mal aufgrund einer hellen gelben Spektrallinie bei einer Wellenlänge von 587,49 Nanometern im Spektrum der Chromosphäre der Sonne. Diese Beobachtung machte der französische Astronom Jules Janssen in Indien während der totalen Sonnenfinsternis vom 18. August 1868. Als er seine Entdeckung bekannt machte, wollte ihm zunächst niemand glauben, da bislang noch nie ein neues Element im Weltall gefunden wurde, bevor der Nachweis auf der Erde geführt werden konnte. Am 20. Oktober desselben Jahres bestätigte der Engländer Norman Lockyer, dass die gelbe Linie tatsächlich im Sonnenspektrum vorhanden ist und schloss daraus, dass sie von einem bislang unbekannten Element verursacht wurde. Weil diese Spektrallinie nahe an der so genannten Fraunhofer D-Linie lag, nannte er die Linie D3, um sie von den nahe liegenden D1- und D2-Linien des Natriums unterscheiden zu können. Er und sein englischer Kollege Edward Frankland schlugen vor, das neue Element nach dem griechischen Wort für Sonne zu benennen. Da sie annahmen, dass es sich bei dem Element um ein Metall handelte, hängten sie statt der für Edelgase üblichen Endung -on die neutrale Endung -ium an.
| Eigenschaften | |
|---|---|
| Allgemein | |
| Name, Symbol, Ordnungszahl | Helium, He, 2 |
| Serie | Edelgase |
| Gruppe, Periode, Block | 18, 1, s |
| Aussehen | Farbloses Gas |
| CAS-Nummer |
|
| EG-Nummer | 231-168-5 |
| ECHA-InfoCard | |
| ATC-Code |
|
| Massenanteil an der Erdhülle | 0,004 ppm |
| Physikalisch | |
| Aggregatzustand | gasförmig |
| Dichte | 0,1785 kg·m−3 |
| Magnetismus | diamagnetisch (χm = −1,1 · 10−9) |
| Schmelzpunkt | 0,95 K (-272,2 °C)(bei 2,5 MPa) |
| Siedepunkt | 4,22 K (-268,93 °C) |
| Molares Volumen | (fest) 21,00 · 10−6 m3/mol |
| Verdampfungswärme | 0,083 kJ/mol |
| Schmelzwärme | 0,02 kJ/mol |
| Schallgeschwindigkeit | 970 m/s bei 273,15 K |
| Spezifische Wärmekapazität | 5193 J/(kg · K) |
| Wärmeleitfähigkeit | 0,1513 W/(m · K) |
| Chemisch | |
| Oxidationszustände | 0 |
| Oxide (Basizität) | keine (keine) |
| Elektronegativität | 5,2 (Durchschnitt), (Pauling-Skala) |
Luigi Palmieri gelang es 1882, durch die Spektralanalyse von Vesuv-Lava erstmals das Element Helium auf der Erde nachzuweisen.

Am 23. März 1895 gewann der britische Chemiker William Ramsay Helium, indem er das Uran-Mineral Cleveit, eine Varietät des Uraninits, mit Mineralsäuren versetzte und das dabei austretende Gas isolierte. Er war auf der Suche nach Argon, konnte jedoch die gelbe D3-Linie beobachten, nachdem er Stickstoff und Sauerstoff von dem isolierten Gas getrennt hatte. Dieselbe Entdeckung machten fast gleichzeitig der britische Physiker William Crookes und die schwedischen Chemiker Per Teodor Cleve und Nicolas Langlet in Uppsala in Schweden. Diese sammelten ausreichende Mengen des Gases, um dessen Atommasse feststellen zu können.
Bei einer Ölbohrung in Kansas/USA wurde eine Erdgasquelle gefunden, deren Erdgas zwölf Volumenprozent eines unbekannten Gases enthielt. Die amerikanischen Chemiker Hamilton Cady und David McFarland der Universität von Kansas fanden 1905 heraus, dass es sich dabei um Helium handelte. Sie publizierten eine Meldung, dass Helium aus Erdgas gewonnen werden kann. Im selben Jahr stellten Ernest Rutherford und Thomas Royds fest, dass Alphateilchen Heliumkerne sind.
Die erste Verflüssigung von Helium wurde 1908 vom niederländischen Physiker Heike Kamerlingh Onnes durchgeführt, indem er das Gas auf eine Temperatur von unter 1 K kühlte. Festes Helium konnte er auch bei weiterem Abkühlen nicht erhalten, dies gelang erst 1926 Willem Hendrik Keesom, einem Schüler Onnes`, durch Komprimieren des Heliums auf 25 bar bei analoger Temperatur. Onnes beschrieb zuerst das Phänomen suprafluider Flüssigkeiten, das heute als Onnes-Effekt bekannt ist.
Im frühen 20. Jahrhundert wurden große Mengen Helium in Erdgasfeldern der amerikanischen Great Plains gefunden und damit wurden die Vereinigten Staaten zum führenden Weltlieferanten für Helium. Nach einem Vorschlag von Sir Richard Threlfall förderte die US-Marine drei kleine experimentelle Heliumproduktionsbetriebe während des Ersten Weltkrieges, um Helium als Füllgas für Sperrballone zu gewinnen. Eine Gesamtmenge von 5.700 Kubikmeter Gas mit einem Heliumanteil von 92 % wurde von diesen Betrieben gewonnen. Dieses Helium wurde 1921 im ersten heliumgefüllten Luftschiff benutzt, dem C-7 der US-Navy.
Die Regierung der USA ließ 1925 die National Helium Reserve in Amarillo / TX errichten, um eine Versorgung von militärischen Luftschiffen in Kriegszeiten und Verkehrsluftschiffen in Friedenszeiten zu sichern. Das Lager befindet sich in einer natürlichen Gesteinsformation 20 km nordwestlich von Amarillo. Obwohl die Nachfrage nach dem Zweiten Weltkrieg sank, wurde die Förderungsanlage in Amarillo erweitert, damit flüssiges Helium als Kühlmittel für Sauerstoff-Wasserstoff-Raketentreibstoff und andere zu kühlende Gegenstände bereitgestellt werden konnte. Der Heliumverbrauch der USA stieg im Jahr 1965 auf das Achtfache des Spitzenverbrauchs in Kriegszeiten.
Die Reinheit des gewonnenen Heliums stieg nach dem Zweiten Weltkrieg rasant an. Wurde 1945 noch eine Mischung von 98 % Helium und 2 % Stickstoff für Luftschiffe benutzt, konnte 1949 bereits Helium mit einer Reinheit von 99,995 % kommerziell vertrieben werden. Um diesen Reinheitsgrad zu erreichen, ist Aktivkohle nötig, um verbliebene Verunreinigungen - meistens bestehend aus Neon - mittels Druckwechsel-Adsorption zu entfernen.
Vorkommen
Im Weltall
Nach der Urknalltheorie entstand der größte Teil des heute im Weltraum vorhandenen Heliums in den ersten Minuten nach dem Urknall. Helium ist nach Wasserstoff das zweithäufigste Element. Etwa 23 % der Masse der sichtbaren Materie bestehen aus Helium, obwohl Wasserstoffatome achtmal häufiger sind. Außerdem wird Helium durch Kernfusion in Sternen produziert. Dieses so genannte Wasserstoffbrennen liefert die Energie, die die Sterne auf der Hauptreihe, also die Mehrheit aller Sterne, zum Leuchten bringt. Dieser Prozess liefert den Sternen die Energie für den größten Teil ihres Lebens.
Helium kann in Meteoriten und oberflächlichem Mondgestein auch durch Wechselwirkung mit Kosmischer Strahlung erzeugt werden. Besonders 3He kann deswegen benutzt werden, um das sogenannte Bestrahlungsalter, welches meist dem Zeitraum vom Entstehen des Meteoriten bis zu seiner Ankunft auf der Erde entspricht, zu bestimmen. Daneben entsteht 4He in Meteoriten durch Zerfall schwerer radioaktiver Elemente. Auch gibt es in Meteoriten weitere Heliumanteile, welche aus der Zeit der Entstehung des Sonnensystems stammen, zum Teil aber auch aus dem Sonnenwind aufgefangen wurden.
Auf der Erde
4He entsteht im Erdkörper beim radioaktiven Zerfall schwerer Elemente wie Uran oder Thorium, wobei Helium-Kerne als Alphateilchen ausgesandt werden und anschließend Elektronen einfangen. Es kann in verschiedenen uran- und thoriumhaltigen Mineralen wie der Pechblende gefunden werden.
Aus der Entstehungszeit der Erde stammt ein Anteil von 3He im Erdmantel, der weit über dem atmosphärischen Wert liegt, das sogenannte Mantelhelium; das 4He/3He-Verhältnis liegt im oberen Erdmantel, der weitgehend entgast ist und dessen Heliumbestand daher im Wesentlichen durch 4He aus Alpha-Zerfällen wiederaufgefüllt wird, bei etwa 86.000. Wenn das Konvektionssystem des unteren Erdmantels weitgehend von dem des oberen getrennt und der Massenaustausch zwischen beiden entsprechend gering ist, liegt das Verhältnis im unteren, kaum entgasten Mantel zwischen 2500 und 26.000, das heißt, der Anteil von 3He ist noch höher. Von besonderem geodynamischen Interesse ist dies im Hinblick auf die Ursachen von Hotspot-Vulkanismus: während für Basalte von mittelozeanischen Rücken, die durch Schmelzprozesse von Material des oberen Mantels entstehen, 4He/3He = 86.000 typisch ist, weisen Basalte von einigen Hotspots, zum Beispiel ozeanischen Vulkaninseln wie Hawaii und Island, Verhältniswerte auf, die rund ein Drittel oder Viertel von 86.000 betragen, sind also drei- bis viermal 3He-reicher. Dies wird gemeinhin damit erklärt, dass dieser Vulkanismus durch Mantelplumes verursacht wird, deren Ursprung an der Kern-Mantel-Grenze liegt und die daher zumindest teilweise aus Material des unteren Erdmantels bestehen.
Helium kommt — durch den gleichen Mechanismus der Ansammlung — in Erdgas und in geringen Mengen im Erdöl (0,4 %) vor. In unteren Schichten der Erdatmosphäre, besonders der vom Wetter durchmischten Troposphäre beträgt sein Anteil etwa 5,2 ppm. In sehr hoher Schichtung entmischen sich Gase tendenziell entsprechend ihrer unterschiedlichen Dichte etwa entgegen der durchmischenden Wirkung der ungerichteten molekularen Wärmebewegung. Oberhalb 100 km Höhe (Homosphäre) liegt die Atmosphäre zunehmend entmischt vor, Helium wird so in großen Höhen (> 400 km, partikelanzahlmässig) das vorherrschende Gas. Auch entweichen Heliumatome in diesen Höhen in den Weltraum — im Gleichgewichtsfall durchschnittlich so viel, wie aus der Erdoberfläche durch Diffusion, Förderung und Vulkanismus nachgeliefert wird.
Künstliche Gewinnung
Erdgas mit einem Heliumanteil bis zu 7 % ist der größte und wirtschaftlich wichtigste Heliumlieferant. Da Helium eine sehr niedrige Siedetemperatur besitzt, ist es durch Herunterkühlen des Erdgases möglich, das Helium von den anderen im Erdgas enthaltenen Stoffen, wie Kohlenwasserstoffen und Stickstoffverbindungen, zu trennen.
Viele Jahre lang gewannen die USA über 90 % des kommerziell nutzbaren Heliums der Welt. Noch 1995 wurden in den USA insgesamt eine Milliarde Kubikmeter Helium gefördert. Der restliche Anteil wurde von Förderungsanlagen in Kanada, Polen, Russland (wobei große Mengen in den unzugänglichen Gebieten Sibiriens liegen) und anderen Ländern geliefert. Nach der Jahrtausendwende kamen Algerien und Katar dazu. Algerien konnte sich rasch zum zweitwichtigsten Heliumlieferanten entwickeln. 2002 stellte Algerien 16 % des Heliums her, das in der Welt vertrieben wurde.
Bei Amarillo in Texas lagerte 2004 etwa das Zehnfache des Weltjahresbedarfs an Helium. Diese ehemals strategische Reserve der US-amerikanischen Regierung muss jedoch aufgrund des Helium Privatization Act der Clinton-Regierung aus dem Jahr 1996 innerhalb der nächsten Jahre an die Privatwirtschaft verkauft werden.
Mittlerweile wird in den USA angenommen, dass die nationalen Vorräte an Helium innerhalb der kommenden zehn Jahre aufgebraucht sein werden. Dies hätte wegen der Bedeutung von Helium unter anderem bei der Glasfaser- und der Computerchipherstellung erhebliche Auswirkungen auf die entsprechenden Industrien.
Das Isotop 3He ist nur zu etwa 1,4 ppm in natürlichem Helium enthalten und ist daher sehr teuer. Prinzipiell kann es auch in Kernreaktionen gewonnen werden. Tritium und 4He können durch Neutronenbeschuss von Lithium 6Li in einem Kernreaktor gewonnen werden:
Das Tritium zerfällt durch Betazerfall zu 3He.
Auch werden sehr geringe Mengen von Helium 3He in mit Wasser moderierten Reaktoren erbrütet, wenn die im Wasser enthaltenen Wasserstoffatome Neutronen einfangen. Aus dem normalen Wasserstoff bildet sich dadurch Schwerer Wasserstoff (Deuterium) und daraus durch einen weiteren Neutroneneinfang Überschwerer Wasserstoff (Tritium), der durch Betazerfall zu Helium 3He wird. Bei normalem Wasserstoff ist die Einfangrate höher als beim darauf folgenden Schritt des Neutroneneinfanges durch schweren Wasserstoff (deshalb können Kernkraftwerke, die Schweres Wasser als Moderator verwenden, auch mit Natururan betrieben werden):
- Die angegebenen Zeiten sind Halbwertszeiten.
Eigenschaften
Physikalische Eigenschaften
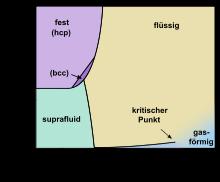
hcp: hexagonal-dichteste Kugelpackung.
bcc: kubisch-raumzentriertes Kristallsystem
Helium ist nach Wasserstoff das chemische Element mit der geringsten Dichte und besitzt die niedrigsten Schmelz- und Siedepunkte aller Elemente. Daher existiert es nur unter sehr tiefen Temperaturen als Flüssigkeit oder Feststoff. Bei Temperaturen unter 2,17 K liegt 4He in einer suprafluiden Phase vor. Bei Normaldruck wird Helium selbst bei einer Temperatur von 0 K nicht fest. Erst bei einem Druck oberhalb 2,5 MPa (rund 25-facher Atmosphärendruck) geht Helium bei hinreichend tiefen Temperaturen in eine feste Phase über.
Im gasförmigen Zustand
Helium ist ein farbloses, geruchloses und ungiftiges Gas. Unter Standardbedingungen
verhält sich Helium nahezu wie ein ideales
Gas. Helium ist unter praktisch allen Bedingungen einatomar. Ein Kubikmeter
Helium hat bei Standardbedingungen eine Masse von 179 g. Luft hat dagegen die etwa siebenfache Dichte.
Helium weist nach Wasserstoff die größte thermische Leitfähigkeit unter allen Gasen auf, und seine spezifische
Wärmekapazität ist außergewöhnlich groß. Helium ist ein guter elektrischer
Isolator.
Die Wasserlöslichkeit von Helium ist geringer als bei jedem anderen Gas. Seine Diffusionsrate durch Festkörper beträgt das
Dreifache von Luft und ca. 65 % von Wasserstoff.
Helium hat bei Standardbedingungen einen negativen Joule-Thomson-Koeffizienten,
das heißt, dieses Gas erwärmt sich bei Ausdehnung. Erst unterhalb der Joule-Thomson-Inversionstemperatur
(circa 40 K bei Atmosphärendruck) kühlt es sich bei Expansion ab. Daher muss Helium unter diese
Temperatur vorgekühlt werden, ehe es durch Expansionskühlung verflüssigt werden
kann. Seine kritischen Daten sind ein Druck von 2,27 bar, eine Temperatur
−267,95 °C (5,2 K) und eine Dichte 0,0696 g/cm3.
Im flüssigen Zustand
Helium I
Bei Normaldruck bildet Helium zwischen dem Lambdapunkt bei 2,1768 K und dem Siedepunkt bei 4,21 K eine farblose Flüssigkeit.
Helium II
Flüssiges 4He entwickelt unterhalb seines Lambdapunktes sehr ungewöhnliche Eigenschaften. Helium mit diesen Eigenschaften wird als Helium II bezeichnet. Das Sieden von Helium II ist wegen seiner hohen Wärmeleitfähigkeit nicht mehr möglich. Erhitzen bewirkt stattdessen eine direkte Verdampfung der Flüssigkeit in den gasförmigen Zustand, wenn der "Siedepunkt" erreicht ist.
Helium II ist ein suprafluider Stoff. So fließt es etwa durch kleinste Öffnungen in Größenordnungen von 10−7 bis 10−8 m und hat keine messbare Viskosität. Jedoch konnte bei Messungen zwischen zwei sich bewegenden Scheiben eine Viskosität ähnlich der von gasförmigem Helium festgestellt werden. Dieses Phänomen wird mit dem Zwei-Fluid-Model (rsp. Zwei-Flüssigkeiten-Modell) nach László Tisza erklärt. Laut dieser Theorie ist Helium II wie ein Gemisch aus 4He-Teilchen im normal-fluiden sowie im suprafluiden Zustand, demnach verhält sich Helium II so, als gäbe es einen Anteil an Heliumatomen mit und einen ohne messbarer Viskosität. Anhand dieser Theorie können viele Phänomene der Tiefentemperaturphysik wie zum Beispiel der "Thermomechanische Effekt" relativ einfach und klar erklärt werden. Allerdings muss man deutlich darauf hinweisen, dass die zwei Flüssigkeiten weder theoretisch noch praktisch trennbar sind.

Helium II zeigt wie andere suprafluide Flüssigkeiten den Onnes-Effekt: Wenn eine Oberfläche aus dem Helium hinausragt, bewegt sich das Helium auf dieser Fläche auch gegen die Schwerkraft. Helium II entweicht auf diese Weise aus einem Behälter, der nicht versiegelt ist. Wenn es einen wärmeren Bereich erreicht, verdunstet es. Aufgrund dieses Kriechverhaltens und der Fähigkeit des Heliums II, selbst durch kleinste Öffnungen auszulaufen, ist es sehr schwierig, flüssiges Helium in einem begrenzten Raum zu halten. Es ist ein sehr sorgfältig zu konstruierender Behälter nötig, um Helium II aufzubewahren, ohne dass es entweicht oder verdunstet.
Die Wärmeleitfähigkeit von Helium II ist größer als die jeder anderen bekannten Substanz, was durch den Effekt des zweiten Schalls beschrieben wird. Sie ist eine Million mal höher als die von Helium I und mehrere hundert Mal höher als die des Kupfers. Sie ist so hoch, weil die Wärmeübertragung durch quantenmechanische Effekte bestimmt wird. Die meisten gut wärmeleitenden Materialien besitzen ein Valenzband freier Elektronen, die die Wärme gut leiten. Helium II hat kein solches, sondern leitet den Wärmepuls mit einer Geschwindigkeit von 20 m/s bei 1,8 K. Dieser Vorgang kann durch eine Wellengleichung beschrieben werden.
1971 gelang David M. Lee, Douglas D. Osheroff und Robert C. Richardson, das Helium-Isotop 3He ebenfalls in einen suprafluiden Zustand zu versetzen, indem sie das Isotop unter die Temperatur von 2,6 Millikelvin abkühlten. Dabei geht man davon aus, dass zwei Atome 3He ein Paar bilden, ähnlich einem Cooper-Paar. Dieses Paar besitzt ein magnetisches Moment und ein Drehmoment. Die drei Wissenschaftler erhielten für diese Entdeckung 1996 den Nobelpreis für Physik.
In festem Zustand
Helium kann als einziger Stoff unter Normaldruck nicht verfestigt werden. Dies gelingt nur unter erhöhtem Druck (etwa 2,5 MPa) und bei sehr niedriger Temperatur (weniger als 1,5 K). Der beim Phasenübergang entstehende, fast vollkommen durchsichtige Feststoff ist sehr stark komprimierbar. Im Labor kann dessen Volumen um bis zu 30 % verringert werden; Helium ist mehr als 50-mal leichter komprimierbar als Wasser. Im festen Zustand bildet es kristalline Strukturen aus. Festes und flüssiges Helium sind optisch kaum voneinander zu unterscheiden, da ihre Brechungsindizes fast gleich sind.
In einem anderen Fall kann bei Unterschreiten von etwa 200 mK und gleichzeitigem Zentrifugieren ein Zustand erreicht werden, den man suprasolide oder auch suprafest nennt. Hierbei stoppt ein Teil des Feststoffes die eigene Rotation und durchdringt die restlichen Teile der Materie. Zu diesem teilweise umstrittenen Effekt gibt es noch keine bekannten Thesen oder Theorien.
Chemische Eigenschaften
Helium ist ein Edelgas. Die einzige Elektronenschale ist mit zwei Elektronen voll besetzt. Beide Elektronen sind durch die räumlich Nähe zum Atomkern sehr stark an diesen gebunden. Nicht zuletzt deswegen ist Helium selbst im Vergleich zu anderen Edelgasen ausgesprochen reaktionsträge. Das zeigt sich auch an den hohen Ionisierungsenergien des Heliumatoms.
Isotope
| 3He | 4He | |
|---|---|---|
| Ruheenergie in MeV | 2809 | 3728 |
| Dichte in kg/m3 | 0,134 | 0,178 |
| Kritische Temperatur in K | 3,32 | 5,20 |
| Lambdapunkt in K | 0,0025 | 2,1768 |
| Schmelzdruck bei T = 0 K in MPa | 3,439 | 2,536 |
| Siedepunkt in K | 3,19 | 4,21 |
Von den acht bekannten Isotopen des Heliums sind lediglich 3He und 4He stabil. In der Erdatmosphäre existiert pro Million 4He-Atome nur ein 3He-Atom. Jedoch variiert die Proportion der beiden Isotope je nach dem Herkunftsort der untersuchten Heliumprobe. Im interstellaren Medium sind 3He-Atome hundert Mal häufiger. In Gesteinen der Erdkruste und des Erdmantels liegt die Proportion ebenfalls weit über dem atmosphärischen Wert und variiert je nach Herkunft um den Faktor 10. Diese Variationen werden in der Geologie benutzt, um die Herkunft des Gesteines zu klären (siehe auch Natürliches Vorkommen).
3He und 4He weisen aufgrund der unterschiedlichen Symmetrieeigenschaften (3He-Atome sind Fermionen, 4He-Atome sind Bosonen) einige unterschiedliche physikalische Eigenschaften auf, die sich insbesondere bei tiefen Temperaturen zeigen. So trennen sich gleiche Anteile von flüssigem 3He und 4He unter 0,8 Kelvin aufgrund ihrer unterschiedlichen Quanteneigenschaften in zwei unmischbare Flüssigkeiten, ähnlich Öl und Wasser. Dabei schwimmt eine Phase aus reinem 3He auf einer Phase, die hauptsächlich aus 4He besteht. Weiterhin unterscheiden sich die zwei Isotope deutlich in ihren suprafluiden Phasen (siehe Abschnitt [Helium II]).
Kernfusion
In Ankündigungen neuer Raumfahrt-Missionen der USA, Russlands und Chinas, weiterhin auch Europas, Indiens und Japans zum Mond wurden mehrfach die dortigen anteilig größeren Vorkommen von 3He als lohnende Quelle genannt, um Kernfusionsreaktoren auf Basis dieses Isotops auf der Erde zu ermöglichen. Im Gegensatz zur Deuterium-Tritium-Fusionsreaktion liefert die Deuterium-3He-Reaktion bei ähnlich großem Energiegewinn keine freien Neutronen, sondern Protonen. Dies würde die Radioaktivitätsprobleme der Fusionsenergiegewinnung dramatisch verringern. Andererseits ist die Herbeiführung dieser Reaktion wegen der nötigen viel höheren Plasmatemperatur eine noch ungelöste technische Herausforderung.
Verwendung
Im Handel angebotenes, komprimiertes Helium wird aus Erdgas gewonnen. Es wird vielseitig verwendet:
- Helium-Sauerstoff-Gemisch (80:20) dient in der Intensivmedizin als Atemgas. Das Gemisch strömt mit geringerem Widerstand durch Verengungen und lässt sich daher leichter atmen.
- Beim kommerziellen Tauchen werden verschiedene Gemische mit Helium wie Trimix (bestehend aus Sauerstoff, Stickstoff und Helium), Hydreliox (Wasserstoff, Helium und Sauerstoff) und Heliox (Helium und Sauerstoff) als Atemgas verwendet. Nachteilig wirkt sich hier die hohe Wärmeleitfähigkeit des Heliums aus, was zum Auskühlen der Lunge des Tauchers führt.
- In der Lebensmittelindustrie wird es als Treibgas oder Packgas verwendet und ist als Lebensmittelzusatzstoff E 939 zugelassen.
- Helium ist ein bevorzugtes Traggas für Ballons und Luftschiffe; es hat eine sehr geringe Dichte, brennt nicht und kann als Luft-Helium-Gemisch nicht explodieren. Helium hat Wasserstoff weitgehend verdrängt, auch wenn seine Dichte höher und damit seine Tragkraft etwas niedriger als die des Wasserstoffs ist. Die technische Anforderung an die Hülle ist aufgrund der hohen Diffusionsrate höher als bei anderen Gasen.
- In der Schweißtechnik wird Helium in Reinform oder als Zumischung als Inertgas eingesetzt, um die Schweißstelle vor Sauerstoff zu schützen. Zudem lässt sich bei Einsatz von Helium die Einbrenntiefe und die Schweißgeschwindigkeit steigern sowie die Bildung von Spritzern verringern, was insbesondere bei Roboterschweißungen und bei der Verarbeitung von Aluminium und rostfreien Stählen zum Einsatz kommt.
- Technisch wird verflüssigtes Helium (die Isotope 4He und 3He) als Kühlmittel zum Erreichen sehr tiefer Temperaturen eingesetzt (Kryostat). Mit 4He lassen sich durch Verdampfungskühlen Temperaturen bis etwa 1 K erreichen, mit dem Isotop 3He bis etwa 240 mK. Mit dem Verfahren der 3He-4He-Mischungskühlung werden bis etwa 5 mK erreicht, wobei dieses Verfahren deutlich kostengünstiger als eine reine 3He-Kühlung ist. Beim Einsatz von supraleitenden Magneten dient Helium als Kühlmittel, um damit den Supraleiter unter seiner Sprungtemperatur zu halten. Praktische Anwendungen sind hier besonders die Kernspintomographie (MRT) für medizinische Anwendungen sowie die Magnetresonanzspektroskopie (NMR) und der Betrieb von Teilchenbescheunigern in der Forschung. In der Raumfahrt kühlt flüssiges Helium Infrarotteleskope und die hochempfindlichen Infrarotkameras in Weltraumteleskopen, die nur nahe dem Absoluten Nullpunkt ohne zu stark störende Eigenwärme arbeiten können. Beispiele sind: Infrared Astronomical Satellite (IRAS), Spitzer-Weltraumteleskop Spitzer- und das Herschel-Weltraumteleskop. Ein weiteres Anwendungsgebiet ist die Herstellung von optischen Glasfasern in heliumgekühlten Falltürmen.
- Komprimiertes Heliumgas kann als Kühlmittel eingesetzt werden, insbesondere dort, wo ein chemisch wie auch kernphysikalisch besonders inertes Kühlmittel benötigt wird. Kernphysikalisch inert ist allerdings nur die Hauptkomponente He-4, während He-3 durch thermische Neutronen leicht in radioaktives Tritium überführt wird. Als Beispiel sei der Thorium-Hochtemperaturreaktor (kurz: THTR) genannt, wo das Helium bei sehr hohen Temperaturen verwendet wurde. Zu beachten ist, dass Helium zwar eine hohe spezifische, aber eine niedrige molare Wärmekapazität besitzt. Dies ist insbesondere bei geschlossenen Apparaturen problematisch, da es im Falle eines Temperaturanstiegs (zum Beispiel bei Stromausfall) schnell zu einer massiven Druckerhöhung kommt.
- Die Suche nach Undichtigkeiten in Druckgasarmaturen wird durch eine Befüllung mit Helium erleichtert. Außen an der Druckarmatur wird ein Lecksuchspray aufgebracht. Helium dringt besonders leicht durch Leckstellen und erzeugt deutlichere Schaumblasen als das Betriebsgas.
- Bei Vakuumanlagen wird Helium als diffusionsfreudigstes Lecksuchgas eingesetzt, indem die Vakuumapparatur mit einer Pumpe evakuiert wird und ein Massenspektrometer hinter die Pumpe gehängt wird. Wird nun die Apparatur — außen, nur lokal um Leckstellen zu finden — mit Helium angeblasen, kann mit Hilfe des Massenspektrometers ein eventueller Heliumeintritt in die Apparatur detektiert und die Leckrate gemessen werden. Diese rasche und empfindliche Lecksuchmethode wird auch an Chemieanlagen und bei der Fertigung von Wärmetauschern für Klimaanlagen oder Benzintanks für Autos benutzt.
- Helium wird in Gasform in der Raketentechnik eingesetzt, um bei pumpgeförderten Flüssigtreibstoffraketen den verbrauchten Treibstoff zu ersetzen, damit die dünnwandigen Treibstofftanks der Raketen nicht implodieren, wenn der Treibstoff von den Treibstoffpumpen der Triebwerke aus den Tanks gesaugt wird. Bei druckgasgeförderten Flüssigtreibstoffraketen drückt Helium den Treibstoff in die Triebwerke. Helium wird hier wegen seines niedrigen Gewichtes und seiner niedrigen Siedetemperatur benutzt. Da es als Edelgas nicht mit dem Treibstoff reagieren kann, stellen auch aggressive hypergolische Treibstoffe kein Problem dar.
- Helium wird als Hilfsgas in verschiedenen Lasertypen eingesetzt, zum Beispiel dem Helium-Neon-Laser, dem Helium-Cadmium-Laser sowie einiger Typen des Kohlendioxidlasers. Es dient als Stoßpartner zur An- oder Abregung der Laserniveaus der eigentlichen aktiven Lasermedien.
- Reinsthelium dient als Trägergas in der Gaschromatographie (Analytik).
- In Gasentladungsröhren leuchtet Helium gelblich/weiß.
- Aufgrund seiner thermodynamischen Eigenschaften ist Helium ein sehr gutes Arbeitsmedium für Stirlingmotoren.
Gefahren
Helium zählt zu den Inertgasen und ist ungiftig. Bei der Handhabung von größeren Mengen gasförmigen Heliums müssen dann Sicherheitsmaßnahmen getroffen werden, wenn aufgrund der Gasmenge und der räumlichen Situation die Gefahr besteht, dass es zu einer Verdrängung von Atemluft kommen kann. Die Unfallzahlen durch Ersticken sind bei Helium im Gegensatz zu anderen häufig als Inertgas eingesetzten Gasen (z. B. Stickstoff) niedriger, da aufgrund der geringen Dichte gasförmiges Helium sofort aufsteigt und es somit auch in schlecht belüfteten Räumen im unteren Bereichen nur in seltenen Fällen zu einer vollständigen Sauerstoffverdrängung der Umgebungsluft und damit zu der Gefahr einer Erstickung kommt. Potentielle Gefahrenbereiche können Ansammlungen von Heliumgas in nach oben dichten baulichen Strukturen sein, beispielsweise Dachstühle, unter denen sich eine „Heliumblase“ bilden kann.
Beim Hantieren mit Flüssig-Helium (UN-Nummer UN 1977) – es ist um 73 K kälter als Flüssig-Stickstoff, der ebenfalls als „tiefkalt“ bezeichnet wird – ist die Verwendung von Schutzkleidung notwendig, um Erfrierungen durch Kontakt zu verhindern. Die Gefahr geht im Wesentlichen von tiefgekühlten Behältern, Apparaturen und Armaturen bzw. durch die Vorkühlung durch LN2 aus, da Flüssig-Helium selbst nur eine extrem geringe Kühlleistung (220 ml LHe hat die Kühlleistung von 1 ml LN2) hat. Eine Schutzbrille schützt die Augen oder ein Visier das ganze Gesicht, dichte Handschuhe einer gewissen Dicke und mit Stulpe die Hände. Offene Taschen oder Stiefelschäfte sind Eintrittspforten für Spritzer und daher zu vermeiden. Weitere Gefahren gehen durch Vereisung und damit verbundener Verstopfung und Explodieren von Leitungen und Gefäßen aus.
Heliumdruckgasbehälter – meist nahtlose Stahlzylinder für 200 bar Hochdruck oder aber geschweißte (oft: Einweg-)Flaschen – stehen unter hohem Druck. Ihr Erhitzen über den Richtwert von 60 °C oder Kontakt mit Feuer ist strikt zu vermeiden. Denn einerseits steigt der Innendruck mit der Temperatur und andererseits nimmt die Festigkeit der Stahlwandung ab, sodass ein sehr energisches Platzen des Gefäßes droht. Auch das Abreißen des Ventils, etwa wenn eine Flasche ohne Schutzkappe fällt, oder das Brechen einer Berstscheibe löst einen Gasstrahl mit gefährlichen Folgen aus.


© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 05.11. 2021