Zellzyklus
| Übergeordnet |
| Biologischer Prozess |
| Untergeordnet |
| Mitose Meiose Endomitose Endoreplikation |
| Gene Ontology |
|---|
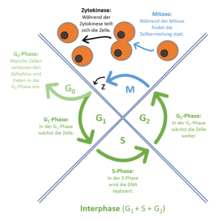
Der Zellzyklus ist die Abfolge verschiedener Aktivitätsphasen zwischen den Teilungen eukaryotischer Zellen. Da der DNA-Gehalt einer Zelle bzw. eines Zellkerns bei der Teilung (Mitose) halbiert wird, muss er vor der nächsten Teilung wieder verdoppelt werden. Diese beiden Vorgänge werden als M-Phase und S-Phase (von Synthese) bezeichnet. Zwischen ihnen liegen sogenannte Gap-Phasen (engl. Lücke): G1 und G2.
Phasen
Nach Teilung der Mutterzelle beginnen die Tochterzellen die Interphase.[1] In dieser Phase zwischen zwei Mitosen sind die einzelnen Chromosomen auch nach Anfärbung nicht als einzelne Einheiten zu erkennen. Die Genaktivität steuert den Stoffwechsel der wachsenden Zelle. Ihr Zellkern entwickelt mindestens einen Nukleolus. Wegen des Gehaltes an ribosomaler RNA sind Nukleoli Voraussetzung und Anzeichen für den zellulären Stoffwechsel. Ein wichtiger Prozess während der Interphase ist die Verdoppelung der Chromosomen.
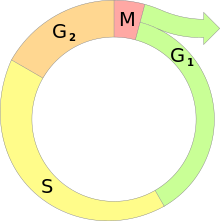
Dies geschieht während der Synthese- oder S-Phase. Ihr voraus geht die G1-Phase. Entsprechend folgt auf die S-Phase die G2-Phase.[2]
- G1-Phase
- Die Bezeichnung G1-Phase kommt von gap (engl. Lücke, Abstand), da dies der Zeitraum zwischen Kernteilung und DNA-Synthese
ist.[2] In dieser (postmitotischen bzw. präsynthetischen) Phase werden Zellbestandteile
(Zytoplasma, Zellorganelle) ergänzt. Die Produktion von
mRNAs für Histone und
Replikationsenzyme
(DNA-Polymerasen, Ligasen) ist Voraussetzung für die bevorstehende S-Phase. Aus dem gleichen Grund steigt der Vorrat an Desoxyribonukleosid-Triphosphaten. Im Zytoplasma tierischer Zellen trennen sich die beiden Zentriolen
voneinander.
Jedes Chromosom besteht aus nur einer Chromatide bzw. einer DNA-Helix. Der DNA-Gehalt der G1-Zelle kann mittels DNA-Zytometrie als 2 C bestimmt werden. Der C-Wert steht für die Größe des (haploiden) Genoms eines Organismus.[3]- Zellen wechseln von der G1-Phase in die G0-Phase, wenn keine weitere Vermehrung der Zelle bevorsteht (ruhende Zelle). Es kann sich dabei um Zellen handeln, die sich nie wieder teilen werden, wie Nervenzellen und Muskelzellen der gestreiften Muskulatur. Andere Zelltypen verbleiben nach ihrer Ausdifferenzierung für Wochen oder Monate in G0, können aber bei besonderen Ereignissen wie Verletzung oder Zellverlust wieder zum G1-Zustand zurückkehren und sich nachfolgend teilen.[4] Beispiele hierfür sind Leberzellen (Hepatozyten) und Lymphozyten.
- S-Phase
- steht für Synthesephase, wegen der Verdopplung der DNA im Zellkern. Ausgelöst von genetischen Signalen,
beginnt in jedem Chromosom an mehreren Ursprüngen die Replikation, die Verdoppelung der
DNA-Helix.[5] Aus dem Zytoplasma gelangen entsprechende Mengen neuer Histone in den Zellkern, welche die replizierte DNA verpacken.
Auch die Zentriolen verdoppeln sich.[6]
Die S-Phase endet, sobald die DNA-Verdopplung abgeschlossen ist und jedes Chromosom aus zwei Chromatiden besteht. Die DNA-Menge steigt in dieser Phase von 2 C auf 4 C. - G2-Phase
- In diesem (postsynthetischen bzw. prämitotischen) Intervall werden RNA-Moleküle und zellteilungsspezifische Proteine synthetisiert, um die nachfolgende Mitose vorzubereiten. Das Endoplasmatische Retikulum wird eingeschmolzen. In Geweben lösen sich die Kontakte zu den Nachbarzellen; die Zelle rundet sich ab und vergrößert sich durch Flüssigkeitsaufnahme.
- M-Phase
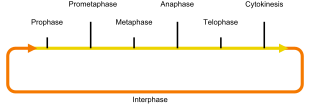
- oder Mitose-Phase: Hier finden die Zweiteilungen der Chromosomen (Mitose), des Zellkernes (Karyokinese) und der Zelle (Zytokinese) statt. Während der Mitose folgen aufeinander:
Prophase, Prometaphase, Metaphase,
Anaphase und Telophase, die Zellteilung beginnt meist schon parallel
zu den letzten Phasen der Mitose. Durch die Zellteilung halbiert sich die DNA-Menge von 4 C
wieder auf 2 C.
- Wird keine Zellteilung durchgeführt und die DNA-Menge weiter verdoppelt, spricht man von Endoreplikationen. Genutzt wird dies in manchen Hochleistungszellen für erhöhte Proteinbiosynthese.
Dauer
Die Dauer des Zellzyklus, d.h. die Zeit zwischen aufeinanderfolgenden Zellteilungen, kann sehr unterschiedlich sein:
- Sie ist mit am kürzesten während der Furchungsteilungen im frühesten Entwicklungsstadium tierischer Embryonen, in der eine große Cytoplasma-Masse innerhalb kurzer Zeit in viele Zellen aufgeteilt werden und ein Zyklus knapp 10 Minuten dauert. Dabei entfallen die G1- und die G2-Phase fast völlig, S- und M-Phase sind beschleunigt.
- Sie ist am längsten bei Zellen, die sich zeitweilig oder endgültig nicht mehr teilen. In diesen erfolgt nach der letzten Mitose keine Replikation mehr, die Zelle verharrt in der G0-Phase.
| Zelltyp | Dauer der Phase | ||||
|---|---|---|---|---|---|
| G1 | S | G2 | M | gesamt | |
| Schleimpilz (Physarum polycephalum) | sehr kurz | 2 h | 4 h | 0,7 h | 6,7 h |
| Bohne (Vicia faba) Meristem der Wurzelspitze | 4 h | 9 h | 3,5 h | 2 h | 18,5 h |
| Maus (Mus musculus) Tumorzellen in Kultur | 10 h | 9 h | 4 h | 1 h | 24 h |
| Mensch (Homo sapiens) Tumorzellen in Kultur[4] | 8 h | 6 h | 4,5 h | 1 h | 19,5 h |
Regulation
Äußere Faktoren
Zu den Faktoren, die den Zellzyklus regulieren, gehören die Zellgröße und das Nährstoffangebot. Auch die An- oder Abwesenheit von Nachbarzellen spielt eine Rolle. Tierische Zellen, die dicht gewachsen sind, teilen sich nicht mehr weiter, sie gehen in das G0-Stadium über. Weiterhin steuern in Geweben die für sie bestimmten Wachstumsfaktoren den Verlauf des Zyklus.
Bestimmte Chemikalien können in Kultur wachsende Zellen in einem bestimmten Zellzyklusstadium festhalten und so die Zellen einer Kultur synchronisieren. Dazu werden zum Beispiel Desoxythymidin und Aphidicolin verwendet, welche die Zellen in der S-Phase halten.[8]
Innere Faktoren und Kontrollpunkte
Dauer und Abfolge der Phasen werden an Kontrollpunkten (Checkpoints) überwacht. Sie sorgen dafür, dass der nächste Schritt im Zellzyklus erst dann erfolgt, wenn der vorhergehende abgeschlossen ist. An den Checkpoints besteht die Möglichkeit, den Zellzyklus lediglich zu unterbrechen (Arretierung) oder den programmierten Zelltod (Apoptose) einzuleiten.
Es existieren spezielle Zellzyklusproteine wie die CDKs (Cycline Dependent Kinases) und die Cycline. Zu bestimmten Zeitpunkten im Zyklus werden diese Proteine verstärkt exprimiert, bis ihre Konzentration ein Maximum erreicht. Von diesem Maximum nimmt man an, dass es den Kontrollpunkt darstellt. Danach werden die Cycline schnell abgebaut. CDKs und die zugehörigen Cycline bilden Komplexe, deren Aktivierung (Dephosphorylierung von Thr14 und Tyr15 durch cdc25) beziehungsweise Deaktivierung unter anderem durch Wachstumsfaktoren und Protoonkogene gesteuert wird. Die CDKs phosphorylieren und aktivieren spezifisch eine Reihe anderer Proteine und steuern so den Zellzyklus.
Beispiel für einen Checkpoint ist der
- Kontrollpunkt für DNA-Schäden: Fehlen Nukleotide, ist der DNA-Stoffwechsel anderweitig gestört oder ist die DNA durch Strahlen oder chemische Stoffe (Mutagene) geschädigt, erzeugt dies ein Signal (p53, das p21 aktiviert). Es bewirkt, dass die Zelle in einer der beiden G-Phasen oder in der S-Phase verharrt. Trifft es die S-Phase, wird die DNA-Synthese gestoppt mittels Inhibition des Cyclin D/CDK4/6-Komplexes, des Cyclin E/CDK2-Komplexes und der Delta-Untereinheit der DNA-Polymerase. Reparaturgene werden aktiviert, um die DNA-Schäden zu beheben.
- Kontrollpunkt der Spindelbildung: Die Trennung der Chromatiden in der Anaphase der Mitose wird so lange unterbunden, bis alle Zentromere (Kinetochore) mit Transportfasern des Spindelapparates verbunden sind und die Chromosomen in der Äquatorialplatte nebeneinander angeordnet sind.
Einleitung der Zellteilung
Die Kernteilung (Mitose) und schließlich die Zellteilung wird bei Eukaryoten durch den Mitosis Promoting Factor (MPF) eingeleitet. Der Proteinkomplex MPF besteht aus der Cyclin-abhängigen Kinase „CDK1“ und dem „Cyclin B“. In der aktiven Form phosphoryliert der Komplex verschiedene Eiweiße – wie etwa das Histon H1 – und beginnt damit die Prophase der Mitose. Die aktivierten Histone bewirken eine Spiralisierung, das sogenannte „Supercoiling“ der DNA, welches eine der Grundvoraussetzungen für den Beginn der Kernteilung ist.[9]
Zellzyklus und Krebs
Der Zellzyklus neoplastischer Zellen (Krebszellen) wird nicht mehr durch den Organismus kontrolliert. Diese Zellen teilen sich autonom. Die Dauer eines Zellzyklus ist gegenüber normalen Zellen verändert.
Die Entdeckung des Zellzyklus ermöglichte einen tieferen Einblick in die Krebsentstehung. Fehlregulationen im Zellzyklus können zu einem unkontrollierten Zell- und damit Gewebewachstum führen. Dabei gehen wichtige Regulationsproteine (z.B. p53) durch Mutation verloren oder werden übermäßig exprimiert.
Nobelpreis für Medizin
Für ihre Entdeckungen zur Kontrolle des Zellzyklus erhielten die Wissenschaftler Leland H. Hartwell (USA), Tim Hunt (UK) und Paul M. Nurse (UK) im Jahre 2001 den Nobelpreis für Medizin.
Einzelnachweise
- ↑ H Lundegård: Fixierung, Färbung und Nomenklatur der Kernstrukturen, ein Beitrag zur Theorie der zytologischen Methodik. In: Archiv für Mikroskopische Anatomie 80: 223–273, 1912.
- ↑ Hochspringen nach: a b A Howard, SR Pelc: Synthesis of desoxyribonucleic acid in normal and irradiated cells and its relation to chromosome breakage. In: Heredity, 6, 1953, S. 261–273.
- ↑ Swift Hewson Hoyt: The constancy of desoxyribose nucleic acid in plant nuclei. In: Proceedings of the National Academy of Sciences USA, 36, 1950, S. 643–654.
- ↑ Hochspringen nach: a b Renate Huch(Hrsg.), Klaus D. Jürgens (Hrsg.): Mensch Körper Krankheit, 6. Auflage, 2011, Urban & Fischer Verlag/Elsevier, ISBN 978-3-437-26792-5, S. 34.
- ↑ Joel A Huberman, Arthur D Riggs: On the mechanism of DNA replication in mammalian chromosomes. In: Journal of Molecular Biology, 32, 1968, S. 327–341.
- ↑ Katharina Munk (Hrsg.): Grundstudium Biologie – Biochemie, Zellbiologie, Ökologie, Evolution. Spektrum Akademischer Verlag, Heidelberg / Berlin 2000, ISBN 3-8274-0910-1, S. 13–14.
- ↑ Katharina Munk (Hrsg.): Grundstudium Biologie – Biochemie, Zellbiologie, Ökologie, Evolution. Spektrum Akademischer Verlag, Heidelberg Berlin 2000, ISBN 3-8274-0910-1, S. 13–15.
- ↑ Pedrali-Noy, G. et al.: Synchronization of HeLa cell cultures by inhibition of DNA polymerase alpha
with aphidicolin, in: Nucleic Acids Res. 1980 8(2):377–387;
 PMID 6775308,
PMID 6775308,
 PMC 327273 (freier Volltext)
PMC 327273 (freier Volltext)
- ↑ Hamid Emminger, Christian Benz: Physikum exakt: Das gesamte Prüfungswissen für die 1. Äp. 4. Auflage, Georg Thieme Verlag, 2005, ISBN 978-3-13-107034-0, S. 18


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 05.01. 2026